化合物G是一种医药中间体,常用于制备抗凝血药。可以通过下图所示的路线合成:
已知:RCOOH RCOCl;D与FeCl3溶液能发生显色。
RCOCl;D与FeCl3溶液能发生显色。
请回答下列问题:
(1)B→C的转化所加的试剂可能是_______________,CH3COCl+E→F的反应类型是_______________。
(2)有关G的下列说法正确的是________。
| A.属于芳香烃 |
| B.能与FeCl3溶液发生显色反应 |
| C.可以发生水解、加成、氧化、酯化等反应 |
| D.1mol G最多可以跟4mol H2反应 |
(3)E的结构简式为__________。
(4)F与足量NaOH溶液充分反应的化学方程式为______________________________。
(5)写出同时满足下列条件的E的同分异构体的结构简式____________________。
①能发生水解反应②与FeCl3溶液能发生显色反应③苯环上有两种不同化学环境的氢原子
(6)已知:工业上以氯苯水解制取苯酚,而酚羟基一般不易直接与羧酸酯化。苯甲酸苯酚酯( )是一种重要的有机合成中间体。试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)。
)是一种重要的有机合成中间体。试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)。
注:合成路线的书写格式参照如下示例流程图:
铁、铜及其化合物在工农业生产中应用广泛。
(1)在潮湿空气中,钢铁发生电化学腐蚀转化为Fe(OH)2的反应方程式为。在含有等浓度硫酸溶液的下列装置中,铁腐蚀的速率由快到慢的顺序是(用序号填写)。
(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s) H="-1118" kJ·mol-1
H="-1118" kJ·mol-1
②2Al(s)+3/2O2(g)=A12O3(s) H="-1675.7" kJ·mol-1
H="-1675.7" kJ·mol-1
则焊接钢轨时铝与Fe3O4发生反应生成铁和Al2O3的热化学方程式为。
(3)Na2FeO4具有强氧化性,其电解制法如图所示,请写出阳极的电极反应式。Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其原理是。
(4)工业上常用FeCl3溶液腐蚀印刷线路板,发生反应的离子方程式是。若腐蚀铜板后的溶液中,Cu2+、Fe3+和Fe2+浓度均为0.1 mol·L-1,结合下图分析,当混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为。从图中数据计算Fe(OH)2的溶度积Ksp[Fe(OH)2]=。
已知:横坐标为溶液的pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度 10-5 mol·L-1时,可认为沉淀完全)。
10-5 mol·L-1时,可认为沉淀完全)。
利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g) CO(g)+3H2(g)。
CO(g)+3H2(g)。
(1)甲烷与水蒸气反应,被氧化的元素是,当生成标准状况下35.84L合成气时转移电子的物质的量是。
(2)将2 mol CH4和5 mol H2O(g)通入容积为100L的反应室,CH4的平衡转化率与温度、压强的关系如图。
①达到A点所需的时间为5min,则v(H2)=,100℃时平衡常数K=。
②图中的Pl P2(填“<”、“>”或“=”),A、B、C三点的平衡常数KA、KB、KC的大小关系是。
(3)合成气用于合成氨气时需除去CO,发生反应CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g) H<0,
H<0,
下列措施中能使 增大的(选填编号)。
增大的(选填编号)。
A.降低温度B.恒温恒容下充入He(g)
C.将H2从体系中分离D.再通入一定量的水蒸气
可用碳酸钾溶液吸收生成的CO2,常温下pH=10的碳酸钾溶液中水电离的OH-的物质的量浓度为,常温下,0.1 mol·L-1KHCO3溶液pH>8,则溶液中c(H2CO3)c(CO32-)(填“>”、“=”或“<”)。
选做(12分)【化学-有机化学基础】
下列为合成聚合物F的路线图: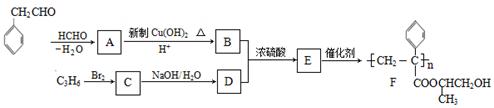

请根据以上信息,回答下列问题:
(1)A中含有官能团(不考虑苯环,下同)名称是_________,C的系统命名为_________。
(2)B+D→E的反应类型是__________,检验B中所含官能团所用的试剂有_______。
(3)C生成D的反应化学方程式为_____________________________,如果C与NaOH的醇溶液反应,则生成的有机物的结构简式为_______________。
(4)G物质的相对分子质量比 的相对分子质量大2,则符合下列条件的G的同分异构体有____种。
的相对分子质量大2,则符合下列条件的G的同分异构体有____种。
①分子中含有苯环,且苯环上有两个取代基 ②遇氯化铁溶液变紫色
近年来大气问题受到人们越来越多的关注。按要求回答下列问题:
Ⅰ.实现反应CH4(g)+CO2(g) 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。
2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。
则p1、p2、p3、p4由大到小的顺序,该反应的正反应是______(填“吸热”或“放热”)反应,当1000℃甲烷的转化率为80%时,该反应的平衡常数K=________。
Ⅱ.PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ·mol-1
CH4(g)+2NO2 (g)= N2(g) + CO2(g)+2H2O(g)△H3
则△H3=,如果三个反应的平衡常数依次为K1、K2、K3,则K3=__________(用K1、K2表示)
(2)实验室可用NaOH溶液吸收SO2,某小组同学在室温下,用pH传感器测定向20mL0.1mol·L-1NaOH溶液通入SO2过程中的pH变化曲线如图所示。
①ab段发生反应的离子方程式为________________。
②已知d点时溶液中溶质为NaHSO3,此时溶液中离子浓度由大到小的顺序为_______,如果NaHSO3的水解平衡常数Kh=1×10-12mol·L-1,则该温度下H2SO3的第一步电离平衡常数Ka=________________。
MnO2是重要化学物质,某学习小组设计了将粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品转化为纯MnO2实验,其流程如下: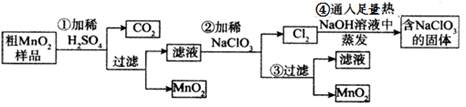
按要求回答下列问题
(1) 第②步操作中,氧化性强弱顺序:ClO3-______ MnO2 (填“>”“<”),当NaClO3转移2mol电子时,生成的氧化产物的物质的量为________mol。NaClO3在常温下能够与盐酸反应生成氯气,该反应的离子方程式为___________________。
(2)第④步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的_________
a.NaClb.NaClOc.NaClO4d.NaOH
(3)MnO2是碱性锌锰电池的正极材料,则碱性锌锰电池放电时,正极的电极反应式是:__________。
(4)为得到纯净的MnO2,须将过滤后的MnO2合并后进行洗涤,判断是否洗涤干净可选用的试剂是______(填写一组即可)。工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该反应的阳极反应式为_____________。