饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2+2H2O。请回答下列问题:
(1)上述反应中,氧化剂是 氧化产物是 。
(2)上述反应中,若有5mol铝原子参与反应,则转移的电子为 mol,用“双线桥法”表示反应中电子转移的方向和数目:
10 Al + 6 NaNO3 + 4 NaOH =10 NaAlO2 + 3 N2↑ + 2 H2O
根据中和热的测定实验填空。
取0.55 mol/L的NaOH溶液50mL与0.5mol/L的盐酸50mL置于图3-4所示的装置中
进行反应和测定中和反应的反应热。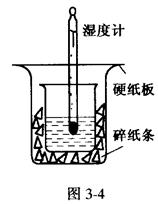
(1)图3-4装置缺少的一种仪器是____________,装置中还存在的错误有____________,这种错误会造成最高温度读数____________(填“增大”、“减小”或“无影响”)。
(2)大烧杯杯口若不盖硬纸板,测得的中和热的数值将____________(填“偏大”、“偏小”或“无影响”)。
(3)假定0.5mol/L的盐酸和0.55mol/L的NaOH溶液的密度都是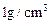 ,中和后生成溶液的比热容为C J/(g.℃)反应前的温度为18℃,反应后最高温度为t℃,则中和热的计算式是△H=________________________。
,中和后生成溶液的比热容为C J/(g.℃)反应前的温度为18℃,反应后最高温度为t℃,则中和热的计算式是△H=________________________。
(4)实验中,若改用60mL 0.5mol/L的盐酸进行实验,与上述实验结果相比,则放出的热量____________(填“增多”、“减小”或“相等”),测得的中和热____________
(填“相同”或“不相同”)。
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 |
C(HA) (mol·L-1) |
C(NaOH) (mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH > 7 |
| 丁 |
0.1 |
0.1 |
pH=8 |
(1).不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸____________________________________________。
(2).不考虑其它组的实验结果,单从乙组情况分析,c是否一定等于0.2_____(填“是”或“否”)。
(3).丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中c(Na+) 、c(A-) 和c(HA) 的浓度由大到小的顺序是________________________________。
(4).写出丁组实验所得混合溶液中下列算式的精确结果(不能作近似计算):
c(Na+)与c(A-)的浓度差为________mol·L-1
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO425.00mL(酚酞作指示剂),滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
| A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,滴入指示剂。 |
| B.用待测定的溶液润洗酸式滴定管 |
| C.用蒸馏水洗干净滴定管 |
| D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0” |
以上2—3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E、检查滴定管是否漏水
F、另取锥形瓶,再重复操作一次
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写);E→C→D→→→→F;
②在G操作中如何确定终点?。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果
(填“偏小”、“偏大”或“不变”)。
(3)如有1mol/L和0.1mol/L的NaOH溶液,应用0.1mol/L的NaOH溶液,原因是______________________。
(4)用标准NaOH溶液滴定时,应将标准NaOH溶液注入__(选填“甲”或“乙”)中。
(5)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度(选填“偏大”“偏小”或“无影响”)
(6)计算待测硫酸(稀释前的硫酸)的物质的量浓度(保留到小数点后二位)。
把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g) ==CO2(g)△H1<0①
途径II:先制成水煤气:C(s) +H2O(g) ==CO(g)+H2(g)△H2>0②
再燃烧水煤气:2CO(g)+O2 (g) ==2CO2(g)△H3<0③
2H2(g)+O2 (g) ==2H2O(g)△H4<0④
请回答下列问题:
(1) 途径I放出的热量( 填“大于”“等于”或“小于”) 途径II放出的热量。
(2) △H1、△H2、△H3、△H4的数学关系式是。
(3)煤炭作为燃料采用途径II的优点有。
下列反应在210℃达到平衡:
PCl5(g) PCl3(g)+Cl2(g)△H>0 K=1①
PCl3(g)+Cl2(g)△H>0 K=1①
CO(g)+Cl2(g) COCl2(g)△H <0 K=5×104②
COCl2(g)△H <0 K=5×104②
COCl2(g) CO(g)+ Cl2(g)△H>0③
CO(g)+ Cl2(g)△H>0③
(1)化学平衡常数K表示可逆反应的进行程度,K值大小与温度的关系是:温度升高,K值__________________(填一定增大、一定减小、或可能增大也可能减小)。
(2)根据反应①的平衡常数K的表达式,平衡时,下列等式必定成立的是
A.c(PCl5) = c(PCl3)= c(Cl2)="1" B.c(PCl5)= c(PCl3)·c(Cl2)="1" C.c(PCl5)= c(PCl3)·c(Cl2)
反应②和反应③的K值表达式(填“相同”或“不同”)
(3)降低Cl2浓度,反应③的K值 ____(填“增大”、“减少”或“不变”)。