实验室需要0.80 mol/L NaOH溶液475 mL和0.40 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题: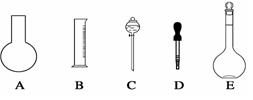
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。
(2)根据计算用托盘天平称取NaOH的质量为 g。在实验中其他操作均正确,若定容时俯视视刻度线,则所得溶液浓度 0.8 mol/L(填“大于”、“等于”或“小于”,下同)。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度 0.8 mol/L。
(3)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为 mL
铁是人类必需的微量元素之一,它可以促进血红蛋白结合氧分子进行输氧,医学上经常用硫酸亚铁糖衣片给患贫血的病人补铁.请根据以下药品说明书回答问题:
(1)药片上的糖衣可以起__________的作用,鉴定时溶解加盐酸的目的是____________。
(2)某研究小组甲欲用KMnO4测定FeSO4的含量。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250毫升,配制时需要的仪器除托盘天平、烧杯、玻璃棒、量筒外,还需要的仪器有__________、___________。
②滴定时含硫酸亚铁的滤液放在___________(填仪器)中,高锰酸钾溶液放在__________(填仪器)中,滴定时加入___________(填“酚酞”或“甲基橙”或“石蕊”或“不用加”)指示剂,如何判断达到滴定终点_____________。
(3)另一研究小组乙设计了如下测量方案: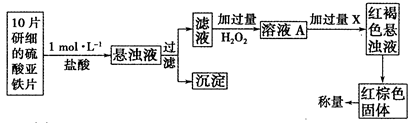
①此检验过程中加过量H2O2反应的离子方程式为______________。
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有___________(按操作的顺序填写)。
| A.过滤 | B.洗涤 | C.萃取 | D.分液 E.冷却 F.灼烧 |
③最后称量红棕色固体的质量为0.8960g,那么该药片中硫酸亚铁的质量分数为_________(小数点后面保留一位有效数字)。
Fe2+和I-是两种常见的还原性离子。
(1)向FeSO4溶液中滴加氯水,溶液由浅绿色变成黄色,反应的离子方程式为;向KI溶液中滴加氯水,溶液由无色变成黄色,反应的离子方程式:。
(2)请以FeSO4溶液、KI溶液、氯水为试剂验证I-的还原性强于Fe2+。设计实验方案,补充完成实验步骤、预期现象和结论。其他限选试剂:3 mol·L-1 H2SO4、0.01 mol·L-1 KMnO4、20% KSCN、3%H2O2、淀粉溶液、紫色石蕊溶液。
| 实验步骤 |
预期现象与结论 |
| 步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加1~2滴氯水。 |
; |
| 步骤2:____________________________________ ____________________________________。 |
(3)利用(2)提供的试剂证明碘与铁的化合物中铁显+2价,实验操作和现象是:取少量样品溶于水,。
硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应△H>0)
某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。
(1)吸硫装置如图所示。
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ,表明SO2吸收效率低的实验现象是B中溶液 。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 、。(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 |
实验操作 |
预期现象 |
结论 |
| ① |
取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,___________________。 |
_______________ |
样品含NaCl |
| ② |
另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,___________________。 |
_______________ |
样品含NaOH |
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取a g KIO3(化学式量:214)固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=_________mol·L-1。(只列出算式,不作运算)
已知:IO3-+5I-+6H+== 3I2+3H2O 2S2O32-+I2==S4O62-+2I-
人体血液里Ca2+离子的浓度一般采用mg/mL来表示。加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定,使草酸转化成CO2逸出。
试回答:
(1)现需要80 mL 0.02 mol·L-1标准KMnO4溶液来进行滴定,则配制溶液时需要的玻璃仪器有烧杯、玻璃棒和______________________;配制时, KMnO4溶液应用强酸酸化,本实验选择________作酸化剂。若选择HNO3酸化,则结果可能________(填“偏大”“偏小”或“不变”)。
(2)草酸与KMnO4反应的离子方程式为______________________________________
(3)滴定时,根据现象___________________________________
即可确定反应达到终点。
(4)滴定的实验数据如下所示:
| 实验编号 |
待测血液的体积/mL |
滴入KMnO4溶液的体积/mL |
| 1 |
20.00 |
11.95 |
| 2 |
20.00 |
13.00 |
| 3 |
20.00 |
12.05 |
经过计算,血液样品中Ca2+离子的浓度为________mg/mL。
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂。以AgNO3标准溶液测定Cl-为例:
终点前:Ag++Cl-=AgCl (白色)
终点时:2Ag++CrO42—=Ag2CrO4(砖红色)
这是因为AgCl溶解度比Ag2CrO4更________的缘故。
(1)某化学兴趣小组的同学进行Cl2、NH3的制备及性质检验等实验的流程和部分装置如下:
①请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2的氧化性强弱为Cl2>Fe3+>I2(实验中不断地小心振荡G装置中的试管)。请写出A中发生反应的离子方程式:______________________________________________,
请写出试剂M为________溶液,证明氧化性为Cl2>Fe3+>I2的实验现象是________________________________________________________________________。
②已知3Cl2+2NH3=6HCl+N2,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b,D中的现象为黄绿色气体消失,产生白烟,反应一段时间后,关闭b打开c,观察到的现象为________________________________________________________________________。
(2)某废水中含有一定量的Na+、SO32—,可能含有CO32—,某研究小组欲测定其中SO32—的浓度,设计如下实验方案: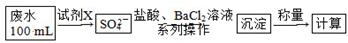
①从下列试剂中选择试剂X为________(填序号);
A.0.1 mol/L KMnO4(H2SO4酸化)溶液B.0.5 mol/L NaOH溶液
C.新制氯水 D.KI溶液
②加入试剂X生成SO42—的离子方程式为_______________________________________
③证明该废水中是否含有CO32—的实验方案为_________________________________________________