下图为元素周期表前四周期的一部分, 且X、Y、Z、R和W为主族元素.下列说法正确的是
| A.Y单质一定既能与盐酸又能与氢氧化钠溶液反应 |
| B.R的最高价氧化物对应的水化物一定是强酸 |
| C.单质X的熔点一定比单质Z的熔点高 |
| D.五种元素的原子最外层电子数一定都大于2 |
已知常温下反应①、②、③的平衡常数关系为K1> K3> K2,据此所做以下推测合理的是 ①NH3+H+ NH4+(平衡常数为K1) ②Ag++Cl—
NH4+(平衡常数为K1) ②Ag++Cl— AgCl(平衡常数为K2)
AgCl(平衡常数为K2)
③Ag++2NH3 Ag(NH3)2+(平衡常数为K3)
Ag(NH3)2+(平衡常数为K3)
| A.氯化银可溶于氨水 | B.银氨溶液中加入少量氯化钠有白色沉淀 |
| C.银氨溶液中加入盐酸无明显现象 | D.银氨溶液可在酸性条件下稳定存在 |
下列实验装置、试剂选用或操作正确的是
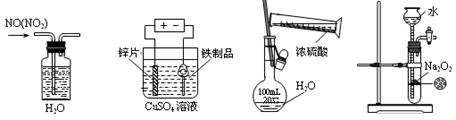
| A.除去NO中的NO2 | B.铁制品表面镀锌 | C.稀释浓硫酸 | D.制备少量O2 |
下列离子方程式正确的是
| A.NH4HCO3溶液中加入过量稀NaOH溶液 NH4++ OH-=NH3·H2O |
| B.FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| C.硫酸亚铁溶液中加入用硫酸酸化的双氧水:Fe2++2H++H2O2=Fe3++2H2O |
| D.在通入过量SO2后的NaOH溶液中加足量的溴水(不考虑SO2的溶解): |
HSO3-+Br2+H2O=3H++2Br-+SO42-
向一定量的Fe,FeO,Fe2O3,Fe3O4的混合溶液中,加入150mL 4mol/L的稀硝酸,恰好使混合物完全溶解,并放出标准状况下NO气体2.24L,往所得溶液中加KSCN溶液,无红色出现。若用一定量的氢气在加热条件下还原相同质量的该混合物,所得固体的物质的量可能为

| A.0.32 mol | B.0.30mol | C.0.28mol | D.0.22 mol |
下列各组离子能大量共存的是
| A.pH=1的溶液中:Fe2+、A13+、Cl-、MnO4- |
| B.能与金属铝反应放出氢气的溶液:K+、NO3-、Cl-、NH4+ |
| C.能使酚酞试液变红的溶液中: Na+、Cl-、S2-、SO32- |
| D.甲基橙为橙色的溶液中:Na+、NH4+、SO42-、CO32- |