利用下图装置,写出除去下列气体中的杂质的方法,并写出化学方程式(括号内的气体为杂质)。
(1)CO2(SO2):
化学方程式: _。
(2)SO2(SO3)(假设SO3为气体): 化学方程式:______________________________________________________
(3)NO(NO2):__________________________________________________。
化学方程式:_____________________________________________________。
(8分)
(1)写出下列反应的离子方程式
①Ca(HCO3)2与过量的NaOH溶液的反应:
②CH3COOH溶液与NaOH溶液反应:
(2)写出下列反应的离子方程式,并在离子方程式中用“单线桥”表示电子转移的方向和数目:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
如果此反应生成了5molCl2,发生氧化反应的HCl的物质的量为mol。
已知: 2Fe2+ + Br2=2Fe3++2Br-;Cl2+2Br-= Br2+2Cl-
在含n mol FeBr2的溶液中,通入Cl2,有x mol Cl2发生反应。
(1)当 时,反应的离子方程式为_________________________
时,反应的离子方程式为_________________________
(2)当反应的离子方程式为:3Cl2+2Fe2+ +4Br-=2Br2+2Fe3+ +6Cl-时,x与n的关系为_____
(3)当Fe2+和Br-同时被氧化时,x与n的关系是_______________
(4)当x=n时,反应后氧化产物的物质的量为________________
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Ca2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到0.08mol气体;
第三份加入足量BaCl2溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g。
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl- ,
(2)由第二份进行的实验可知混合物中应含离子,其物质的量浓度为。
(3)由第三份进行的实验可知12.54g 沉淀的成份为。请计算形成该沉淀的原混合物中各离子的物质的量。
(4)综合上述实验,你认为以下结论正确的是()
| A.该混合物中一定含有K+、NH4+、CO32-、SO42-,可能含有Cl-,且n(K+)≥0.04mol |
| B.该混合物中一定含有NH4+、CO32-、SO42-,可能含有Ca2+、 K+、Cl- |
| C.该混合物中一定含有NH4+、CO32-、SO42-,可能含有K+、Cl- |
| D.该混合物中一定含有NH4+、SO42-,可能含有Ca2+、K+、Cl- |
(7分)对于混合物的分离或提纯,常采用的方法有:过滤、蒸发、蒸馏、萃取、渗析、加热分解等。下列各组混和物的分离或提纯,应采用什么方法或加何种试剂:
(1)除去乙醇中溶解的食盐,方法是________________。
(2)除去Ca(OH)2溶液中悬浮的CaCO3颗粒用________操作。
(3)除去KCl溶液中的SO42-,依次加入的溶液为(填化学式):________、________、________。
(4)用食用酒精浸泡中草药提取其中的有效成分,其过程称________;从碘水中提取碘采用________操作。
(15分:除注明分数的小题之外,其余为1分))
Ⅰ、以下是依据一定的分类标准,对某些物质与水的反应情况进行分类的分类图。请根据你所学的知识按要求填空: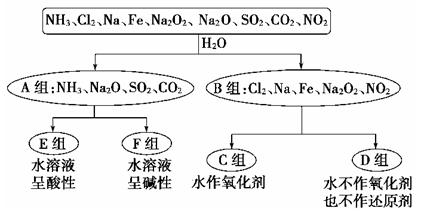
(1)上述第一级分类标准(分成A、B组的依据)是:__________________
(2)D组物质包括_________________________________(填化学式)。
(3)C组物质中某一物质在常温时能与冷水反应,其化学方程式为_________。
(4)D组中某一物质与E组中某一物质在水中反应生成两种强酸,写出该反应的离子方程式:___。
Ⅱ、下图中每一方格表示有关的一种反应物或生成物。A、C为无色气体。
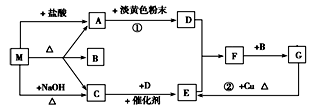
(1)物质M可以是________或________,C是________,F是________。
(2)反应①的化学方程式_________________________________________。
(3)反应②的离子方程式_________________________________________。
(4)F→G的化学方程式___________________________________________。