某研究性学习小组准备探究氯气与溴化亚铁溶液反应的氧化先后问题。
[提出假设]
假设1:Cl2具有氧化性,在溶液中先氧化Fe2+
假设2:Cl2具有氧化性,在溶液中先氧化Br―
[设计实验方案,验证假设]
(1)只要向通入少量氯气后的溴化亚铁溶液中加__________溶液,通过现象就可以验证是假设1成立,还是假设2成立。
(2)请写出溴化亚铁与等物质的量氯气反应的离子方程式__________
某化学课外活动小组,从化学手册上查得硫酸铜在500 ℃以上按下式分解:CuSO4 CuO+SO2↑+SO3↑+O2↑,便决定设计一验证性实验探索测定反应产生的SO2、SO3和O2的物质的量,并经计算以此确定该条件下CuSO4分解反应方程式中各物质的化学计量数。实验可能用到的仪器如下图所示:
CuO+SO2↑+SO3↑+O2↑,便决定设计一验证性实验探索测定反应产生的SO2、SO3和O2的物质的量,并经计算以此确定该条件下CuSO4分解反应方程式中各物质的化学计量数。实验可能用到的仪器如下图所示: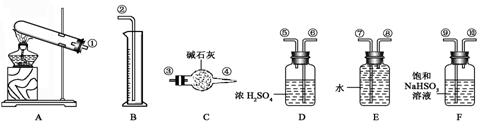
实验测得数据及有关结果如下:
①准确称取6.0 g无水CuSO4;②干燥管总质量在实验结束时增加了2.4 g;③测出量筒中水的体积后,折算成排水的气体,在标准状况下的体积为280 mL;④实验结束时,装置F中的溶液变为NaHSO4溶液(不含其他杂质,且O2在其中的损耗可忽略不计)。试回答下列问题:
(1)按装置从左至右的方向,各仪器连接顺序为(填代号)。
(2)装置F的作用是。
(3)装置D的作用是。
(4)确定装置E的进、出口的原则是:。
(5)首先应计算的是物质的体积;通过计算,推断出该条件下反应的化学方程式:
(6)该实验设计中,可能给测定带来误差最大的装置是___________________(填代号)。
某综合实践活动小组到自来水厂进行参观,了解到源水处理成自来水的工艺流程示意图如下:
⑴源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入CaO后生成Ca(OH)2,进而发生若干复分解反应,试写出其中的一个离子方程式。
⑵加入凝聚剂可以除去其中的悬浮固体颗粒,其过程是。(填写下列各项的序号)①只有物理过程,无化学过程②只有化学过程,无物理过程③既有化学过程又有物理过程;
FeSO4·7H2O是常用的凝聚剂,加入后,最终生成红褐色胶状沉淀,则这种红褐色胶状沉淀是。用化学反应方程式表示实验室制备该胶体的方法:
⑶通入二氧化碳的目的是和。
⑷气体A的作用是。
⑸下列物质中,可以作为气体A的代替品。(填写下列各项的序号)
①ClO2②浓氨水 ③SO2④浓硫酸
某研究性学习小组研究HNO3的氧化性,设计了如下实验:
在盛有新制FeSO4溶液的试管中滴入2滴KSCN溶液,观察现象,然后再滴入几滴浓HNO3,溶液的颜色变红,但是将红色溶液放置一会儿则发现溶液由红色快速变为蓝色,并产生红棕色气体,这一奇特现象激起了同学的好奇心与求知欲望,对此现象设计了探究性实验。
⑴甲同学认为是溶液中的Fe2+的干扰造成的,大家经过理性分析,认为可以排除Fe2+的干扰,理由是。
⑵乙同学认为红色消失,说明Fe(SCN)3被破坏,红棕色NO2说明了某些离子与HNO3发生了氧化还原反应,推测可能是KSCN与HNO3作用。KSCN溶液是一种无色液体,根据C、S、N的原子结构和共价键的相关知识推测SCN-的结构式为。
⑶根据乙同学的观点,设计了实验方案1,往浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色,突然剧烈反应产生大量气泡,放出红棕色气体,而溶液红色消失变为浅绿色,溶液温度升高;继续滴入KSCN,溶液变为浅蓝色,最后变成无色。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种非极性气体;向反应后的溶液中加入BaCl2溶液产生白色沉淀,写出向浓HNO3中滴入KSCN的离子方程式
⑷丙同学认为SCN-的性质还可进一步探究,设计了方案2,向Fe(SCN)3中分别滴加过量的氯水、溴水,溶液的红色均消失变为黄色,而加入碘水时溶液的颜色基本不变。丙同学的设计意图是__
⑸通过本次探究,可以得出以下结论,a、用SCN-间接检验Fe2+时应注意;b、与SCN-反应使溶液变红的是Fe3+。(填“一定”或“不一定”)
(I) 下图甲和乙是某学校王老师制备NH3 并进行性质实验时的改进装置。按图甲把仪器安装好,称取2g固体氯化铵装入试管底部,再快速称取2g氢氧化钠覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2mL 浓氨水);烧杯内盛滴有酚酞试液的水:把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡.
将上述中收满NH3 的圆底烧瓶取下,改装成图乙所示的装置,胶头滴管内事先预吸入2mLH2O ,此时小气球系在玻璃棒上呈自然松驰状态;将滴管内的水慢慢滴入烧瓶中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某个性质。按要求回答下列问题:
(1)中学化学教材中是用与制O2相同的制备装置来加热制取NH3的,该化学方程式为:__________________________________________________________
(2)下面是某同学关于王老师能用图甲制取NH3的原因分析,有道理的是__________。
①在NH3 · H2O 中有平衡 使平衡向左移动
使平衡向左移动
②在NH3· H2O 中有平衡 使平衡向左移动
使平衡向左移动
③Na0H 溶于水时放热,使体系的温度升高,NH3的溶解度减小
④NH4Cl与NaOH 在此情况下可反应生成NH3,
⑤NH4Cl 会分解释放出NH3
(3)图甲中的NH4Cl 与NaOH 固体混合物能否用CaO 固体代替(填”能”与”不能”)
(4)如何判断图甲中烧瓶己收满NH3 ?_____________________________________________
(5)图乙中胶头滴管中的水挤入烧瓶后,观察到的现象是它说明了NH3
(Ⅱ)如上图所示:在B槽中装有500 mL水,容积为a mL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中。充分反应后,试管A中余下气体的体积为0.5a mL,则原混合气体中NO2和NO的物质的量之比为
通过导气管C往余下0.5a mL气体的试管A中持续通入氧气,A中可能观察到的现象是:
___________________________________________________
有关反应的化学方程式为:___________________________________________
当试管A中充满气体时停止通入氧气,然后将试管取出水槽,则共通入氧气的体积为 ________mL,水槽B中溶液的物质的量浓度为mol·L-1(设溶液的体积仍为500 mL)
铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
⑴试剂1是,试剂2是,加入新制氯水后溶液中发生的离子反应方程式是,;
⑵加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为,写出+2价Fe在空气中转化为+3价Fe的化学方程式;
⑶该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗?。若你认为合理,请说明理由(若你认为不合理,该空不要作答);若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答)。