(1) 反应: 2A(g)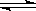 B(g ) xC(g) 在一定的条件下达到平衡状态, 密闭容器中的压强增大P%, 测得A的转化率为 P%, 则x的值为 __________.
B(g ) xC(g) 在一定的条件下达到平衡状态, 密闭容器中的压强增大P%, 测得A的转化率为 P%, 则x的值为 __________.
(2) 在容积相同的两密闭容器A和B中, 保持温度为 423K, 同时向A和B中分别加入 a mol 和 b mol 的HI(a > b), 待反应: 2HI(g)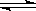 H2(g)+ I2(g)到平衡后, 用 “ > < 或 ="”" 回答下列问题:
H2(g)+ I2(g)到平衡后, 用 “ > < 或 ="”" 回答下列问题:
从反应开始到达到平衡所需要时间: tA _______ tB(填>,<, =", " 下同)
平衡时的碘的浓度: c(I2 )A c(I2 )B
HI的平衡分解百分率为:  .
.
科学实验证明通常状态下并不存在NaAlO2,Al(OH)3溶于强碱溶液形成的阴离子实际是因为Al(OH)3分子中的铝原子最外层电子数未达到饱和,能与OH-离子形成配位键,结合生成[Al(OH)4]-,因此1molAl(OH)3与碱反应时只能中和1molH+,表现为一元酸.
(1)据此请写出Al(OH)3的两性电离的方程式____________________;
(2)硼与铝是同族元素,试推测H3BO3是_____元酸,酸性是________(强或弱);并写出其电离的方程式_____________________________;
已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl2溶液、NaOH溶液、盐酸.按要求回答:
(1) 电工操作上规定不能把铜导线和铝导线连接在一起使用.说明原因 .
(2)若电极材料选铜和石墨,电解质溶液选硫酸铜溶液,外加导线,能否构成原电池?,若能,请写出电极反应式,负极,正极 .(若不能,后面两空不填)
(3)通常说的燃料电池都以铂为电极,将燃烧反应的化学能转化为电能,在燃料电池中,可燃物在 极反应, 在另一极反应。
熔盐电池具有高的发电效率,因而受到重视, 可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得在650℃下工作的燃料电池,完成有关电池反应式。阳极反应式:2CO+2CO32-=4CO2+4e-,阴极反应式:。
电池总反应式:。
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g)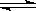 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数Kc |
9.94 |
9 |
1 |
试回答下列问题
(1)上述正向反应是:▲ 反应(选填:放热、吸热)。
(2)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有▲ (选填A、B、C、D、E)。
| A |
B |
C |
D |
E |
|
| n(CO2) |
3 |
1 |
0 |
1 |
1 |
| n(H2) |
2 |
1 |
0 |
1 |
2 |
| n(CO) |
1 |
2 |
3 |
0.5 |
3 |
| n(H2O) |
5 |
2 |
3 |
2 |
1 |
(3)已知在一定温度下:C(s)+CO2(g) 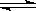 2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g) 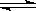 CO(g)+H2(g)平衡常数K1;
CO(g)+H2(g)平衡常数K1;
CO(g)+H2O(g)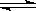 H2(g)+CO2(g) 平衡常数K2 ,
H2(g)+CO2(g) 平衡常数K2 ,
则K、K1、K2之间的关系是:▲ 。
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020 mol/L,在该条件下,CO的最大转化率为:▲ 。
(5)若在800℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为x;平衡时CO转化率为y,则y随x变化的函数关系式为:y= ▲ 。
(6)在VL密闭容器中通入10molCO和10mol水蒸气,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时各物质的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO燃烧热为283kJ/mol,H2燃烧热为286kJ/mol),则T℃平衡常数K= ▲ 。
绿色有机合成是指采用无毒、无害的原料、催化剂和溶剂,选择具有高选择性、高转化率,不生产或少生产对环境有害的副产品合成。下列是BHC公司新发明的布洛芬(Ibuprofen)绿色合成方法。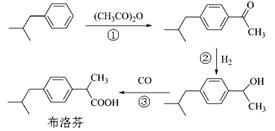
试回答下列问题:
(1)反应③属于羰基合成,反应①、②分别所属的有机反应类型是:▲、▲。
(2)反应①的化学方程式为:▲。
(3)与布洛芬互为同分异构体的芳香族化合物中,其结构可表示为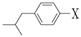 的酯类,X的结构有:▲种(填数字)。
的酯类,X的结构有:▲种(填数字)。
(4)某学生提议用Reppe反应一步合成布洛芬,并使原子利用率100%,已知:RCH=CH2+CO+H2O 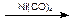 RCH(CH3)COOH,请一种有机原料合成布洛芬:▲
RCH(CH3)COOH,请一种有机原料合成布洛芬:▲