观察下图装置,其中a、b是两根石墨棒,有关电极反应式错误的是
| A.a电极:2Cl-—2e—=Cl2↑ | B.b电极:2H++2e—=H2↑ |
| C.铜电极:2H++2e—=H2↑ | D.锌电极:4OH-—4e—=2H2O+O2↑ |
向100 mL 0.1 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是( )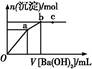
| A.a点时溶液中所含主要溶质为(NH4)2SO4 |
B.a→b段发生反应的离子方程式是:S +Ba2+ +Ba2+ BaSO4↓ BaSO4↓ |
| C.b点为最大沉淀量,对应的纵坐标值为0.02 |
| D.c点加入Ba(OH)2溶液的体积为200 Ml |
某同学用下列装置制备并检验Cl2的性质。下列说法正确的是( )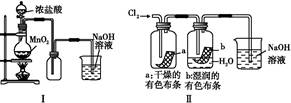

| A.Ⅰ图中:如果MnO2过量,盐酸可全部被消耗 |
| B.Ⅱ图中:湿润的有色布条褪色,证明Cl2有漂白性 |
| C.Ⅲ图中:生成棕色的固体,证明Cl2有强氧化性 |
| D.Ⅳ图中:光照后量筒中气体体积减小,说明甲烷与Cl2发生了加成反应 |
用NA表示阿伏加德罗常数的值。下列叙述中一定正确的是( )
| A.一定条件下4.6 g Na完全与O2反应生成7.2 g产物,失去的电子数为0.2NA |
| B.50 mL 18.4 mol/L浓硫酸与足量铜加热反应,生成SO2的分子数为0.46NA |
| C.一定条件下某密闭容器盛有0.1 mol N2和0.3 mol H2,充分反应后转移电子数为0.6NA |
| D.电解1 L NaCl溶液至c(OH-)="0.2" mol/L,转移电子数为0.4NA |
下列关于有机化合物的说法正确的是( )
| A.甲烷、乙烯和苯在工业上都是通过石油分馏得到 |
| B.乙烯、苯都可以和氢气发生加成反应,都能使酸性高锰酸钾溶液褪色 |
| C.蛋白质、淀粉、油脂都能发生水解反应,它们分子中所含元素种类相同 |
| D.乙醇与乙酸生成乙酸乙酯和乙酸乙酯水解生成乙醇与乙酸的反应类型相同 |
“谁在雾里奔波,谁在雾里哭泣,谁在雾里挣扎,谁在雾里窒息。北京,北京……”是网友对2013年冬北京等多个城市出现严重的雾霾天气的吐槽,可吸入颗粒物是加重雾霾天气污染的罪魁祸首。下列说法不正确的是( )
| A.PM2.5值越大,形成雾霾天气的可能性越大 |
| B.火电及北方冬季供暖烧煤所产生的废气是形成雾霾的一个重要因素 |
| C.目前我国空气污染指数(API)指标数值范围包含二氧化硫(SO2)、二氧化碳(CO2)和可吸入颗粒物三个指标 |
| D.城市由于汽车尾气的大量排放,比农村形成雾霾的可能性大 |