甲、乙两个容器中,分别加入0.1mol/L NaCl溶液与0.1mol/L AgNO3溶液后,以Pt为电极进行电解时, (14分)
(14分)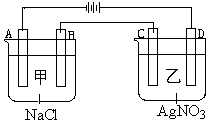
(1)写出电极名称和电极反应式:
A
B
C
D 
(2)在A、D电极上生成的气体物质的量之比为:_____________
Ⅰ.通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示四种微粒:A________,B________,C________,D________。
(2)写出A、B、E三种微粒反应的离子方程式:____________________________________________________。
Ⅱ.(1)CH3+、CH3-、CH3-都是重要的有机反应中间体,它们的电子式分别是________、________、________;其中CH3+中四个原子是共平面的,三个键角相等,则键角应是________。
(2)叠氮化合物在化学工业上有重要应用。N3-叫做叠氮离子,请写出由三个原子构成的含有与N3-的电子数相同的粒子的化学式(3种)________、______、_______。
有A、B、C、D、E、F六种元素,已知:
①它们位于三个不同短周期,核电荷数依次增大。
②E元素的电离能数据见下表(kJ·mol-1):
| I1 |
I2 |
I3 |
I4 |
… |
| 496 |
4 562 |
6 912 |
9 540 |
… |
③B与F同主族。
④A、E分别都能与D按原子个数比1∶1或2∶1形成化合物。
⑤B、C分别都能与D按原子个数比1∶1或1∶2形成化合物。
(1)写出只含有A、B、D、E四种元素的两种无水盐的化学式________________、________________。
(2)B2A2分子中存在________个σ键,________个π键。
氮是地球上极为丰富的元素。
(1)Li3N晶体中氮以N3-存在,N3-的电子排布式为________________。
(2)NN叁键的键能为942 kJ·mol-1,N—N单键的键能为247 kJ·mol-1。计算说明N2中的________键比________键稳定(填“σ”或“π”)。
(1)判断下列各对化合物中键的极性大小,并说明原因。ZnO和ZnS;HI和HCl;H2S和H2Se;H2O和OF2。
(2)某有机物分子的结构简式为 ,该分子中有________个σ键,________个π键,有________种极性键,________(填“有”或“没有”)非极性键。
,该分子中有________个σ键,________个π键,有________种极性键,________(填“有”或“没有”)非极性键。
(3)用电子式表示Cl2、NH3、H2S、CO2分子的形成过程。
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。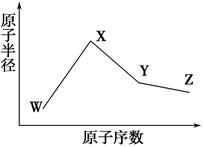
(1)X位于元素周期表中第________周期第________族;W的基态原子核外有________个未成对电子。
(2)Z的气态氢化物和溴化氢相比,较稳定的是________________(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是____________________________________________________。