I.在足量的氯化亚铁溶液中加入少量(1—2滴)液溴,振荡后溶液变为黄色。
(1)甲同学认为是Br2单质溶于水变成黄色溶液;乙认为是Fe2+被氧化成Fe3+使溶液变成黄色。
(2)请根据提供试剂作出判断:
试剂: A 酸性高锰酸钾溶液 B 氢氧化钠溶液 C 四氯化碳 D 硫氰化钾溶液
判断: 两个同学的观点中正确的是__________(填 “甲” 或 “乙”), 并用两种方法(原理不同)加以试验证明, 写出选用的试剂编号及实验中观察到的现象:
| |
选用试剂 |
实验现象 |
| 第一种方法 |
|
|
| 第二种方法 |
|
|
(3) 在FeCl3溶液中加入淀粉碘化钾溶液,能观察到的实验现象是 。若选用淀粉碘化钾溶液来试验某观点的推断正确,你认为是否可行? ;若可行本问不需要回答, 若不可行请说明原因: ________________________________________。
Ⅱ.若要把溶解于水中的Br2单质分离出来,所需要的主要玻璃仪器是_____, 该操作的名称是_ _
(12分)实验室欲用NaOH固体配制1.0 mol/L的NaOH溶液240 mL
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算③溶解 ④摇匀 ⑤转移
⑥洗涤⑦定容 ⑧冷却 ⑨振荡
其正确的操作顺序为______________。本实验必须用到的仪器有托盘天平、药匙、玻璃棒、烧杯、____________。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。烧杯的实际质量为______g,要完成本实验该同学应称出______g NaOH。
(3)使用容量瓶前必须进行的一步操作是______。
(4)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是______。
| A.转移溶液时不慎有少量洒到容量瓶外面 |
| B.定容时俯视刻度线 |
| C.未冷却到室温就将溶液转移到容量瓶并定容 |
| D.定容后塞上瓶塞反复倒转摇匀,静置后,液面低于刻度线,再加水至刻度线 |
某学习小组研究同周期元素性质递变规律时,设计并进行了下列实验(表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
| 实验步骤 |
实验现象 |
| ① 将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
| ② 向新制得的Na2S溶液中滴加新制的氯水 |
B.有气体产生,溶液变成浅红色 |
| ③ 将一小块金属钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体 |
| ④ 将镁条投入稀盐酸中 |
D.反应不十分剧烈;产生无色气体。 |
| ⑤ 将铝条投入稀盐酸中 |
E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥ 向A1Cl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉淀。 |
(1)请将各实验步骤对应的实验现象填写入下表中:
| 实验步骤 |
① |
② |
③ |
④ |
⑤ |
⑥ |
| 实验现象(填A~F) |
C |
D |
(2)此实验可得出的结论是:
Na、Mg、Al金属性强弱关系:,Cl、S非金属性强弱关系:。
(14分)4,7—二甲基香豆素(熔点:132.6℃)是一种重要的香料,广泛分布于植物界中,由间—甲苯酚为原料的合成反应如下:
实验装置图如下:
主要实验步骤:
步骤1:向装置a中加入60mL浓硫酸,并冷却至0℃以下,搅拌下滴入间—甲苯酚30mL(0.29mol)和乙酰乙酸乙酯26.4mL (0.21mol)的混合物。
步骤2:保持在10℃下,搅拌12h,反应完全后,将其倒入冰水混合物中,然后抽滤、水洗得粗产品
步骤3:粗产品用乙醇溶解并重结晶,得白色针状晶体并烘干,称得产品质量为33.0g。
(1)简述装置b中将活塞上下部分连通的目的。
(2)浓H2SO4需要冷却至0℃以下的原因是。
(3)反应需要搅拌12h,其原因是。
(4)本次实验产率为(百分数保留一位小数)
(5)实验室制备乙酸乙酯的化学反应方程式,用(填药品名称)收集粗产品,用(填操作名称)的方法把粗产品分离。
(10分)化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。(已知:S2O32-+2H+===H2O+S↓+SO2↑)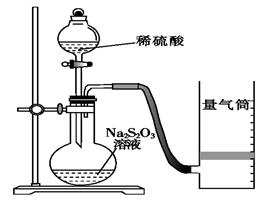
(1)除如图装置所示的实验用品外,还需要的一件实验用品是______________。
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是______________________________________。
(3)利用该化学反应,试简述测定反应速率的其他方法:________________(写一种)。
Ⅱ.探究化学反应速率的影响因素
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。
(已知I2+2S2O32-===S4O62-+2I-,其中Na2S2O3溶液均足量)
| 实验序号 |
体积V/mL |
时间/s |
|||
| Na2S2O3溶液 |
淀粉溶液 |
碘水 |
水 |
||
| ① |
10.0 |
2.0 |
4.0 |
0.0 |
t1 |
| ② |
8.0 |
2.0 |
4.0 |
2.0 |
t2 |
| ③ |
6.0 |
2.0 |
4.0 |
Vx |
t3 |
(4)表中Vx=__________mL,t1、t2、t3的大小关系是__________________________。
我国是氧化铝生产大国,工业上每生产1 t氧化铝将排出1~2 t赤泥,赤泥大量堆积会对环境造成严重污染。赤泥中主要成分及含量:CaO约占46%、SiO2约占22%、Al2O3约占7%、Fe2O3约占11%、TiO2约占5%及少量其他物质。
(1)一种利用废弃赤泥的方法是将赤泥配成一定的液固比,作为一种吸收剂,吸收热电厂排放的含SO2的烟气,写出吸收SO2时可能发生的化学反应方程式______________________。
(2)为综合利用赤泥中的各种成分,某科研小组设计了如下工艺流程: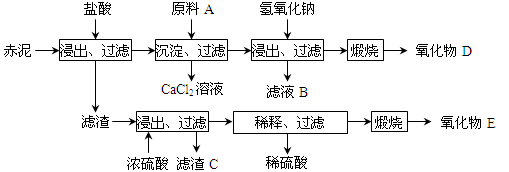
已知:TiO2不溶于稀盐酸、稀硫酸,能溶于浓硫酸生成TiOSO4(硫酸氧钛,易水解)。
①氧化物D的化学式是_____________,原料A最好是下列物质中的____________。
| A.氨水 | B.氢氧化钠 | C.生石灰 | D.双氧水 |
②写出上述工艺中投入氢氧化钠时反应的离子方程式_________________________。
③写出上述工艺中稀释时发生水解反应的化学方程式__________________________。