孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备 CuSO4·5H2O及纳米材料G,步骤如下: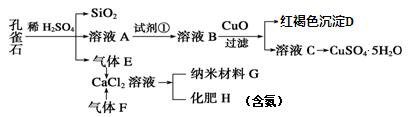
请回答下列问题:
⑴溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①最佳为_____(填代号)。
a. KMnO4 b. (NH4)2S c. H2O2 d. KSCN
向溶液 B中加入CuO的作用是 。
B中加入CuO的作用是 。
⑵由溶液C获得CuSO4·5H2O,需要经过 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
⑶写出制备G的化学反应方程式 。若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。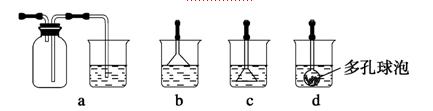
⑷欲测定溶液A中Fe2+的溶液,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应使用 。取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,终点现象为 。
(14分)乙酸异戊酯(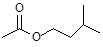 )是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图(有关的加热和夹持仪器略去)和有关数据如下:
)是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图(有关的加热和夹持仪器略去)和有关数据如下: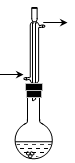
实验步骤:在烧瓶中加入4.4 g的异戊醇,6.0 g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热烧瓶,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁晶体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。回答下列问题:
| 相对分子质量 |
密度/(g·cm-3) |
沸点/℃ |
水中溶解性 |
|
| 异戊醇 |
88 |
0.8123 |
131 |
微溶 |
| 乙酸 |
60 |
1.0492 |
118 |
溶 |
| 乙酸异戊酯 |
130 |
0.8670 |
142 |
难溶 |
(1)写出制取乙酸异戊酯的化学方程式。
(2)冷凝管的作用是,碎瓷片的作用是。
(3)若乙酸异戊酯产率偏低,其原因可能是。
A.原料没有充分反应
B.发生了副反应
C.在进行蒸馏纯化操作时,从143 ℃开始收集馏分
(4)在洗涤、分液操作中,应充分振荡,然后静置,待分层后(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(5)实验中加入少量无水硫酸镁的目的是。
(6)本实验的产率是
A.30℅B.40℅C.50℅ D.60℅
草酸与高锰酸钾在酸性条件下能够发生反应,现用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
组别 |
10%硫酸体积/mL |
温度/℃ |
其他物质 |
| I |
2 mL |
20 |
|
| II |
2 mL |
20 |
10滴饱和MnSO4溶液 |
| III |
2 mL |
30 |
|
| IV |
1 mL |
20 |
1 mL蒸馏水 |
(1)该反应的离子方程式为。
(2)该反应中氧化剂和还原剂的物质的量之比为。
(3)如果研究催化剂对化学反应速率的影响,使用实验I和Ⅱ;如果研究温度对化学反应速率的影响,使用实验(用I~IV表示)。
对比实验I和IV,可以研究对化学反应速率的影响,实验IV中加入1 mL蒸馏水的目的是。
下图是实验室利用无水乙醇、冰醋酸和浓硫酸制备乙酸乙酯的实验装置。试回答: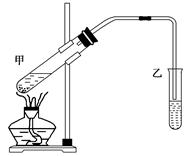
(1)乙酸分子中官能团的名称是__________________。
(2)写出甲中反应的化学方程式_______________________________________________。
(3)小试管乙中饱和Na2CO3溶液的主要作用是__________________________________。
(4)可用____________的方法把制得的乙酸乙酯分离出来。
实验室制取乙酸丁酯的实验装置有如右下图所示两种装置供选用。其有关物质的物理性质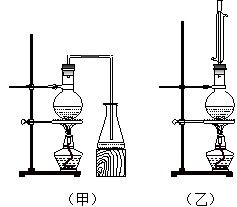
如下表:
| 乙酸 |
1-丁醇 |
乙酸丁酯 |
|
| 熔点(℃) |
16.6 |
-89.5 |
-73.5 |
| 沸点(℃) |
117.9 |
117 |
126.3 |
| 密度(g/cm3) |
1.05 |
0.81 |
0.88 |
| 水溶性 |
互溶 |
可溶(9g/100g水) |
微溶 |
(1)制取乙酸丁酯的装置应选用_______(填“甲”或“乙”)。不选另一种装置的理由是。
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式):、。
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,可采取的措施是。
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是__________(选填答案编号)。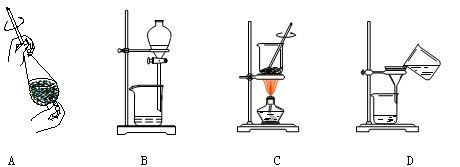
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须;某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还可能。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: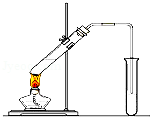
(1)写出制取乙酸乙酯的化学反应方程式:.
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:.
(3)浓硫酸的作用是:①;②.
(4)饱和碳酸钠溶液的主要作用是.
(5)实验中加热小试管的目的是:①;②.
(6)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是.
(7)若要把制得的乙酸乙酯分离出来,应采用的实验操作是.