实验室制取乙酸丁酯的实验装置有如右下图所示两种装置供选用。其有关物质的物理性质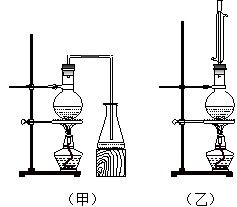
如下表:
| |
乙酸 |
1-丁醇 |
乙酸丁酯 |
| 熔点(℃) |
16.6 |
-89.5 |
-73.5 |
| 沸点(℃) |
117.9 |
117 |
126.3 |
| 密度(g/cm3) |
1.05 |
0.81 |
0.88 |
| 水溶性 |
互溶 |
可溶(9g/100g水) |
微溶 |
(1)制取乙酸丁酯的装置应选用_______(填“甲”或“乙”)。不选另一种装置的理由是 。
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式): 、 。
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,可采取的措施是 。
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是__________(选填答案编号)。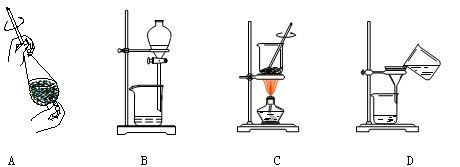
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须 ;某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还可能 。
石油资源紧张曾是制约中国发展轿车事业,尤其是制约轿车进入家庭的重要因素.据2004年5月23日的《扬子晚报》报道,中国宣布将推广“车用乙醇汽油”.乙醇完全燃烧生成CO2和H2O.
(1)写出乙醇完全燃烧的化学方程式______________________________________。
(2)乙醇燃烧时如果氧气不足,可能还有CO生成.用以下装置确证乙醇燃烧产物有CO、CO2、H2O,应将乙醇燃烧产物依次通过(按气流从左到右顺序填装置编号):__________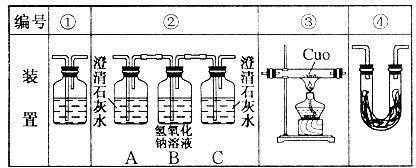
(3)实验时可观察到装置②中A瓶的石灰水变浑浊,C瓶的石灰水不变浑浊.A瓶溶液的作用是___________________________;B瓶溶液的作用是________________________;C瓶溶液的作用是______________________________________.
(4)装置③的作用是将CO氧化成CO2.装置①中所盛的是_________________溶液,作用是________________________________.
(5)装置④中所盛的固体药品是________________,它可以确证产生是____________.
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
| 熔点/℃ |
660 |
2054 |
1535 |
1462 |
| 沸点/℃ |
2467 |
2980 |
2750 |
—— |
(1)请写出铝热反应的化学反应方程式:_______________________。
(2)该同学推测铝热反应所得到的熔融物应是铁铝合金,理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________(填“合理”或“不合理”)。请写出铝热反应的一种工业用途______________________。
(3)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_______,反应的离子方程式为_______ __________________。
(4)实验室要溶解该熔融物,下列试剂中可以选用____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
下表是稀硫酸与金属镁反应的实验数据:
| 实验 序号 |
金属质量/g |
金属 状态 |
c(H2SO4) /mol/L |
V(H2SO4)/mL |
溶液温度/℃ |
金属消失 的时间/s |
|
| 反应前 |
反应后 |
||||||
| 1 |
0.24 |
丝 |
0.5 |
100 |
20 |
34 |
500 |
| 2 |
0.24 |
粉末 |
0.5 |
100 |
20 |
35 |
50 |
| 3 |
0.24 |
丝 |
0.7 |
100 |
20 |
36 |
250 |
| 4 |
0.24 |
丝 |
0.8 |
100 |
20 |
35 |
200 |
| 5 |
0.24 |
粉末 |
0.8 |
100 |
20 |
36 |
25 |
| 6 |
0.24 |
丝 |
1.0 |
100 |
20 |
35 |
125 |
| 7 |
0.24 |
丝 |
1.0 |
100 |
35 |
50 |
50 |
| 8 |
0.24 |
丝 |
1.1 |
100 |
20 |
34 |
100 |
| 9 |
0.24 |
丝 |
1.1 |
100 |
30 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明,对反应速率有影响,反应速率越快,能表明同一规律的实验还有(填实验序号);
(2)其中仅表明反应物浓度对反应速率产生影响是实验2和实验(填实验序号);
(3)本实验中影响反应速率的其他因素还有 ____,能表明这一规律的分别是实验6和实验或实验8和实验;(填实验序号);
(4)实验中的所有反应,反应速率最快是实验(填实验序号),该实验中硫酸平均反应速率为;
实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题: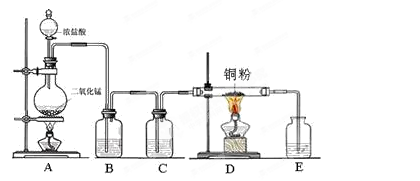
(1)写出烧瓶中发生反应的化学方程式,并标出电子转移情况。
(2)C处盛放的试剂(填名称),其作用是。
(3)E处盛有(填名称),发生反应的离子方程式为。
(4)实验结束时,应先熄灭处酒精灯。
某研究小组为了探究甲烷和氯气反应情况,设计了几个实验。请填写下列空白: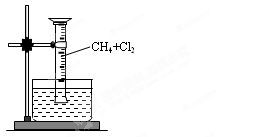
【实验一】用如图所示装置,排水法收集一试管甲烷和氯气的混合气体,光照后观察到量筒内形成一段水柱,认为有氯化氢生成。
(1)该反应的化学方程式为(只写第一步);该反应属于(填反应类型)
(2)水槽中盛放的液体最好为;(填标号)
| A.水 | B.饱和石灰水 | C.饱和食盐水 | D.饱和NaHCO3溶液 |
【实验二】用排蒸馏水法收集一试管甲烷和氯气的混合气体,光照反应后,滴加AgNO3溶液,看到有白色沉淀生成,认为有氯化氢生成。
(3)该实验设计的错误之处 __________________________________;(用反应方程式和必要的文字加以说明)