m mol乙炔跟n mol氢气在密闭容器中反应,一段时间后,生成p mol乙烯,将此时的混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量是
| A.(3m+n)mol | B.(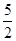 m+ m+ -3p)mol -3p)mol |
| C.(3m+n+2p)mol | D.( 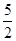 m+ m+ )mol )mol |
某有机物的结构简式为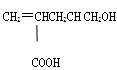 ,下列叙述不正确的是
,下列叙述不正确的是
| A.1mol该有机物能与足量金属钠反应放出1molH2 |
| B.能与乙醇发生酯化反应 |
| C.1mol该有机物在催化剂作用下最多能与1molH2发生还原反应 |
| D.1mol该有机物能与足量NaHCO3溶液反应放出2 molCO2 |
【原创】下列有关物质的应用说法正确的是
| A.可以用铝制槽罐车运输浓硫酸 |
| B.亚硝酸盐可以防腐,所以在食品中可以广泛使用 |
| C.洁厕灵和漂白粉都具有去污作用,一同使用效果会更 |
| D.治疗胃酸过多可以使用碳酸钠 |
【原创】常温常压下,向2L密闭容器中加入一定量的A和B气体,发生反应2A(g) + 2B(g) 2Q(g) + W(g)∆H=M kJ·moL−1,3min后,反应达到平衡,相关数据如下表:
2Q(g) + W(g)∆H=M kJ·moL−1,3min后,反应达到平衡,相关数据如下表:
| 反应时间/min |
n(A)/mol |
n(B)/mol |
| 0 |
4 |
4 |
| 0.5 |
3.2 |
|
| 2 |
2.4 |
|
| 3 |
1.0 |
下列说法正确的是
A.反应在前0.5min时,n(W)=0.6mol
B.2min时,反应的平均反应速率为V(Q)=0.48mol/L·s
C.相同温度条件下,向平衡后的容器中再充入2molQ和2molW时,v (正)> v (逆)
D.相同温度下,平衡时的平衡常数为18L·mol-1
【改编】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知: 3I2+6OH—==IO3—+5I—+3H2O,下列说法正确的是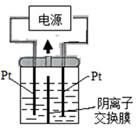
| A.右侧发生的电极方程式: 4OH— -4e— =2O2 ↑+ 2H2O |
| B.电解结束时,右侧溶液中不含有IO3— |
| C.电解槽内发生反应的总化学方程式KI+3H2O=KIO3+3H2↑ |
| D.左侧为阳极,右侧为阴极,电子由右侧Pt电极通过电源流向左侧Pt电极上 |
现有1.0 mol/L的NaOH溶液0.2L,若通入4.48L(标准状况)SO2气体使其充分反应后,则所得溶液中各粒子浓度大小关系正确的是
| A.c(Na+) = c(H2SO3) + c(HSO3―) + c ( H+) |
| B.c(SO32―) + c( OH―) = c(H+) + c(H2SO3) |
| C.c(Na+)+c(H+) = c(HSO3―) +c(SO32―) + c( OH―) |
| D.c(Na+)>c(HSO3―)>c( OH―)>c(H2SO3)>c(SO32―)>c(H+) |