黄铁矿(主要成分为FeS2)曾是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
I.将m1 g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O22Fe2O3+8SO2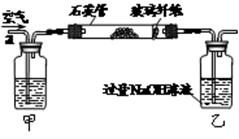
II.反应结束后,将乙瓶中的溶液进行如下图所示处理。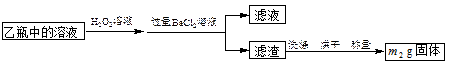
[实验二]测定铁元素的含量。
III.测定铁元素的含量的实验步骤如下图所示。
问题讨论:
(1)上述装置中,甲瓶内所盛试剂是 溶液。
(2)向乙瓶溶液中滴加H2O2溶液时,发生氧化还原反应的离子方程式为 。
II中除了可以用H2O2溶液作为氧化剂,还可以加入 (填序号)。
①氯水 ②浓H2SO4 ③HNO3 ④Fe2(SO4)3
(3)该黄铁矿中硫元素的质量分数为 。
(4)III的步骤②中,若选用铁粉作还原剂,你认为合理吗?并说明理由。(如合理,则此空不填) (填“合理“或”不合理“)、 (如合理,则此空不填)。
(5)若要测定铁元素的含量,则步骤III中还需要测定的数据有 。
实验室常用二氧化锰和浓盐酸反应制备氯气,用下图装置可制备纯净、干燥的氯气,并验证其部分性质。
试回答下列问题:
(1)A中发生反应的化学方程式是。
(2)C、D中所用试剂分别是:C;D。
(3)B中出现的现象是。
(4)请用离子方程式表示F中NaOH溶液的作用。
(5)若想制得标准状况下2.24L氯气,理论上被氧化的HCl的物质的量是mol。
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol・L-1、2.00 mol・L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为20℃、35℃,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验 编号 |
T/℃ |
大理石 规格 |
HNO3浓度 (mol・L-1) |
实验目的 |
| ① |
25 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和探究温度对该反应速率的影响; (Ⅲ)实验①和探究大理石规格(粗、细)对该反应速率的影响; |
| ② |
||||
| ③ |
粗颗粒 |
2.00 |
||
| ④ |
25 |
在生产生活中,金属腐蚀所带来的损失非常严重,所以防止金属腐蚀已经成为科学研究和技术领域的重大问题.兴趣小组的同学在实验室对金属腐蚀进行了探究.
(1)分别在三个洁净干燥的试管中各加一个洁净无锈的铁钉,再在其中两个试管中加入经煮沸迅速冷却的蒸馏水,其它操作请仔细观察图1:____ 号试管中的铁钉最容易生锈.由此可见,铁制品生锈需要的条件是____ _____ .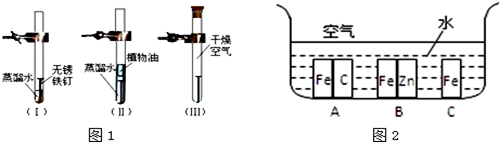
(2)如图2所示,铁处于A、B、C三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)____.
(3)据报道,全世界每年因为金属腐蚀造成的直接经济损失约达7000亿美元,我国因金属腐蚀造成的损失占国民生产总值(GNP)的4%.
①钢铁在发生电化学腐蚀时,负极反应为:________ _ .
②请写出用稀硫酸除去铁锈的化学反应方程式为:____ _____ .
③请根据不同的原理,提出防止钢铁腐蚀的两条合理措施:_________ 、 _____ .
研究化学反应中的能量变化时,在一只小烧杯里,加入20 g已研磨成粉末的Ba(OH)2·8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10 g NH4Cl晶体,根据下图所示实验步骤进行操作。回答下列问题: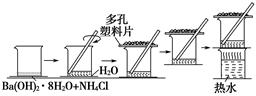
(1)写出实验过程中发生反应的化学方程式:。
(2)检验有NH3生成的方法是。
(3)反应中产生的NH3会污染环境,对人体有害。为减少其挥发,实验时在烧杯上方盖了一个多孔塑料板,反应后移走多孔塑料板,发现混合物成糊状,证明有_____生成。为了更好的解决NH3的污染问题,可以做一个简单的改进,你的改进方法是。
(15分)
Ⅰ.下列实验设计或操作合理的是________。
A.在催化剂存在的条件下,苯和浓溴水发生反应可生成无色比水重的液体溴苯
B.只用水就能鉴别苯、硝基苯、乙醇
C.实验室制取乙烯时需要控制温度在170℃左右,因此使用水浴加热
D.将10滴溴乙烷加入1mL 10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子
E.工业酒精制取无水酒精时先加生石灰然后蒸馏,蒸馏必须将温度计的水银球插入反应液中
F.苯酚中滴加少量的稀溴水,可用来定量检验苯酚
G.将铜片放入盛有无水乙醇的试管中加热,完成乙醇氧化为乙醛的实验
H.为了减缓电石和水的反应速率,可用饱和食盐水来代替水进行实验
Ⅱ.某化学小组以苯甲酸和异丙醇为原料,制取苯甲酸异丙酯( ),已知有关物质的沸点如下表:
),已知有关物质的沸点如下表:
| 物质 |
异丙醇 |
苯甲酸 |
苯甲酸甲酯 |
| 沸点/℃ |
82.4 |
249 |
218 |
合成苯甲酸异丙酯粗产品在如图圆底烧瓶中加入12.2 g苯甲酸和30 mL异丙醇(密度约为0.79 g·cm-3),再小心加入3mL浓硫酸,混匀后,投入几块碎瓷片,小心加热30分钟,使反应完全,得苯甲酸异丙酯粗产品。
(1)仪器A的名称是;加入碎瓷片的目的是;
(2)异丙醇的系统命名法的名称为;浓硫酸的作用是_____________;
(3)若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式________________。
粗产品的精制
(4)苯甲酸异丙酯粗产品中往往含有少量异丙醇、苯甲酸和水等,现拟用下列流程图进行精制,操作①中用到的一种重要仪器是;操作②的名称是__________
(5)通过计算,苯甲酸甲酯的产率为__________________
(6)该实验中不能用于提高苯甲酸甲酯的产率的措施是__________
A.苯甲酸的质量由12.2g增加至24.4g
B.30ml的异丙醇增加至35mL