(12分)
2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(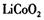 )、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂。某回收工艺流程如下:
)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂。某回收工艺流程如下:
(1)上述工艺回收到的产物有____________________________
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是_________________________________________________
(3)碱浸时主要反应的离子方程式为________________________ 。
(4)酸浸时反应的化学方程式为__________________。最后一步过滤应__________
(5)如何洗涤过滤后的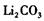 固体 ______________________
固体 ______________________
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)e的基态原子电子排布式为_______。
(2)b、c、d的第一电离能由大到小的顺序是_________(填元素符号)
(3)a和其他元素形成的二元共价化合物中,分子中既含有极性共价键、又含有非极性共价键的化合物是________(填化学式)。
(4)d与c可以形成两种分子,低价态分子中心原子的杂化方式为_______该分子的空间构型为______________
(5)e和c形成的一种离子化合物的晶体结构如图,则该离子化合物的化学式为__________。(填元素符号)
(17分)二甲醚是一种重要的清洁燃料。合成二甲醚是解决能源危机的研究方向之一。
(1)用CO2和H2可以合成二甲醚(CH3OCH3)
(2)已知在一定温度下,以下三个反应的平衡常数为k1、k2、k3:
(3)二甲醚(CH3OCH3)燃料电池可以提升能量利用率。利用二甲醚酸性介质燃料电池电解100mL 1mo1 的食盐水(惰性电极),电解一段时间后,收集到标况下的氢气2.24L(设电解后溶液体积不变)
的食盐水(惰性电极),电解一段时间后,收集到标况下的氢气2.24L(设电解后溶液体积不变)
①二甲醚燃料电池的负极反应式为_____________。
②电解后溶液的PH=_________________________
(4)工业合成氨的反应为: mol-1
mol-1
已知合成氨反应在某温度下2L的密闭绝热容器中进行,测得数据如下表:
根据表中数据计算:
①0 min~1 min内N2的平均反应速率为_________
②该条件下反应的平衡常数k=________(保留两位小数)
③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,
化学平衡向_______(填“正向”、“逆向”或“不移动”),该反应的平衡常数k___________(填“变大”“减小”或“不变”)
(5)常温下,将0.2mol HCOOH和0.1mol
HCOOH和0.1mol NaOH溶液等体积混合,所得溶液的PH<7,说明HCOOH的电离程度____________HCOONa的水解程度(填“大于”或“小于”)。
NaOH溶液等体积混合,所得溶液的PH<7,说明HCOOH的电离程度____________HCOONa的水解程度(填“大于”或“小于”)。
该溶液中[HCOOH]-[OH-]+[H+]=______mol
(14分)已知有A、B、C、D、E五种短周期元素元素,其原子序数依次增大。F是常见的金属,在潮湿的空气中被腐蚀形成红棕色固体。A、C同主族,A与B、A与E形成共价化合物,A与B形成化合物的水溶液呈碱性,E元素的最高正价与最低负价的代数和为6,D是同周期中离子半径最小的元素。
(1)五种元素中,金属性最强的元素在周期表的位置是_______写出D元素的原子结构示意图________
(2)B元素的气态氢化物与其最高价氧化物对应的水化物化合,生成物的水溶液呈_______性,原因____________(离子方程式表示)上述化合物浓溶液滴加到Mg(OH)2悬浊液中,沉淀逐渐消失最后澄清,请解释澄清的原因______________________________________________
(3)含F的二价离子的酸性溶液,在空气中易被氧化变质,该过程的离子反应为:__________________
检验该二价离子没有被完全氧化的方法为:_______________________________
(4)E元素的最高价氧化物对应的水化物与D元素的最高价氧化物对应的水化物反应的化学方程式为____________________________________________________
(5分)化学实验是化学学科学习、探究的基础。
(1)下列描述错误的是_______.
a.为了防止试剂瓶内的试剂被污染,取用后多余的试剂一定都不能放回原试剂瓶
b.滴定管、容量瓶、分液漏斗在使用时都需要检漏
c.海带中碘的提取时需要对干海带进行灼烧,此时需要用到的仪器有玻璃棒、燃烧匙、泥三角、三脚架、酒精灯
d.检验Na2SO3固体是否被氧化:取少量固体溶于水,加入Ba(NO3)2溶液,产生白色沉淀,滴加稀盐酸,观察白色沉淀是否溶解
e.海带中碘的提取时,对碘水中的碘进行萃取可采用裂化汽油、苯、四氯化碳、无水酒精等有机溶剂
(2)某溶液中可能存在Br-、CO32-、SO32-、I-、A13+、Mg2+、Na+等7种离子中的某几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,有白色沉淀生成,加入稀盐酸沉淀不溶解。
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
据此可以推断:该溶液肯定存在的离子是:_______________
在②中产生的自色沉淀是:_________________
选做(12分)【化学一物质结构与性质】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布式为_________,第一电离能最小的元素是__________(填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是________(填化学式)。
(3)B元素可形成多种单质。一种晶体结构如图一所示,其原子轨道的杂化类型为________。另一种的晶胞如图二所示,若此晶胞中的棱长为356.6pm,则此晶胞的密度为_________g·cm-3(保留两位有效数字)。(已知: )
)
(4)D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是________(填选项序号)。
①极性键②非极性键③配位键④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液。请写出沉淀溶解的离子方程式:_________________。