NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液pH>7,原因是(用离子反应方程式表示) 。
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的目的是 。
(3)某小组同学用下图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。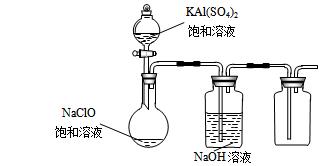
①打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。反应的离子方程式是 。
②将烧瓶中的混合液在阳光照射下,不久烧瓶中有黄绿色气体产生。充分反应后集气瓶中气体能使带余烬的木条复燃。写出在光照下混合液中反应的化学方程式是
。
(4)若将V1 mL 0.1mol/L KAl(SO4)2溶液和V2mL 0.1mol/LBa(OH)2溶液混合。当产生沉淀物质的量最多时,V1:V2 = 。
下列实验操作不正确的是 _。
| A.在催化剂存在的条件下,苯和溴水发生反应可生成无色、比水重的液体溴苯 |
| B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,实现乙醇氧化为乙醛的实验 |
| C.醇中含有少量水可加入硫酸铜再蒸馏制得无水乙醇 |
| D.试管中先加入一定量浓硫酸,再依次加入适量冰醋酸、无水乙醇,然后加热制取乙酸乙酯 |
E.实验室制取乙烯时,放入几片碎瓷片,以避免混合液在受热沸腾时剧烈跳动
F.配制银氨溶液时,将稀氨水慢慢滴入硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
G.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置、待液体分层后,滴加硝酸银溶液
(1)写出下图中序号①~④仪器的名称:
(2)仪器①~④中,使用时必须检查是否漏水的有。(填仪器序号)
(3)分离碘水中的碘应先选择装置(填装置序号)进行操作A,再选装置进行操作。进行操作A时,需在碘水中加一试剂,在选择试剂时,下列性质你认为哪些性质是必需的:(填序号)。
①常温下为液态②I2在其中溶解程度大③与水互溶程度小④密度要比水大
(4)右图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制480 mL 1 mol/L的稀硫酸。
可供选用的仪器有:
①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
a.盛放浓硫酸的试剂瓶标签上应印有下列警示标记中的
b.配制稀硫酸时,还缺少的仪器有、(写仪器名称);
c.经计算,配制480 mL 1 mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为______mL,量取硫酸时应选用mL规格的量筒;
A.10 mL B.50 mL C.100 mL D.200mL
d.对所配制的稀硫酸进行测定,发现其浓度大于1 mol/L,配制过程中下列各项操作可能引起该误差的原因有 ( )。
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.定容时,俯视容量瓶刻度线进行定容
C.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:
如果此方案正确,那么:
(1)操作①可选择_________或_________仪器。
(2)操作②是否可改为加硝酸钡溶液?为什么? ______________________________________
(3)进行操作②后,如何判断SO 已除尽,方法是___________________________。
已除尽,方法是___________________________。
(4)操作③的目的是___________________,为什么不先过滤后加碳酸钠溶液?理由是___________。
(5)操作④的目的是____________________________________。
右图为探讨苯和溴的反应改进的实验装置图。其中A为具支试管改制成的反应容器,在其下端开了一个小孔,并塞好石棉绒,实验时先加少量铁粉于石棉绒上。填写下列空白:
(1) 向反应容器A中逐滴加入溴和苯的混合液,几秒钟内发生反应,写出A中所发生反应的化学方程式、;
(2) 反应开始后观察D和E两试管,看到的现象为、,说明苯和溴发生了反应(填反应类型);
(3) B中的NaOH溶液作用是吸收反应生成的溴苯中溶解的溴单质,则A中铁粉的作用是,试管C中苯的作用是;
(4) 在上述整套装置中,具有防倒吸的仪器除D外还有(填字母)。
(10分) 某学生为验证苯的沸点(80.1℃)比水低,设计了如图1所示的实验装置:(某些固定装置已略去)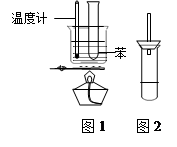
(1) 该实验中能够说明苯的沸点比水低的实验现象是;
(2) 使用该实验装置的一个明显的缺点就是难以控制苯蒸气的大量外逸,有人在盛苯的试管口装上一个带有直玻璃导管的塞子(如右图2所示) ,改进后装置的直玻璃导管能防止苯蒸气的大量外逸的原因是;
(3) 该实验的加热方法是____,其优点是;
(4)苯与浓硝酸、浓硫酸的混合物在100~110℃时的主要产物的结构简式为:。