(一)糖类、油脂、蛋白质都是人体必需的营养物质。
(1)油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和_____________(写名称),进而被氧化生成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料。
(2)氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(—NH2)和________ ____(写结构简式或名称)。
(3)淀粉在淀粉酶的作用下最终水解为葡萄糖(C6H12O6),部分葡萄糖在体内被氧化生成二氧化碳和水。写出葡萄糖在体内被氧化的化学方程式:________________________。
(二)茉莉花香气的成分有多种,乙酸苯甲酯(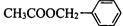 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下: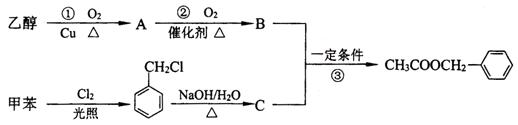
(1)C的结构简式为_______________。
(2)写出反应①的化学方程式:______________ __________ 。
(3)反应③的反应类型为______________ _______________。
(4)反应______ ____(填序号)原子的理论利用率为100%,符合绿色化学的要求。
氨是重要的化工产品和化工原料。
(1)氨的电子式是。
(2)已知: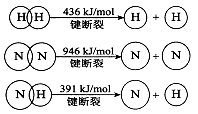
①合成氨的热化学方程式是。
②降低温度,该反应的化学平衡常数K.(填“增大”、“减小’’或“不变”)。
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图l所示。
电池正极的电极反应式是,A是。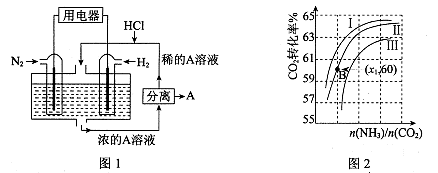
(4)用氨合成尿素的反应为2NH3(g)+CO2(g)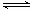 CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比 、水碳比
、水碳比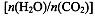 的变化关系。
的变化关系。
①曲线I、II、III对应的水碳比最大的是。
②测得B点氨的转化率为40%,则x1。
氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al与NaOH溶液反应的离子方程式为。
(2)下列实验能比较镁和铝的金属性强弱的是(填序号)。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/LAlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al (s)+3O2(g) =2Al2O3(s)ΔH1 =" -3352" kJ/mol
Mn(s)+ O2(g) =MnO2 (s)ΔH2 =" -521" kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是。
(4)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,其反应方程式为。
(5)工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g) + 2N2(g) + 6H2(g)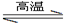 Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是mol/(L·min)。
②若按n(SiCl4) : n(N2) : n(H2) =" 3" : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应(填“增大”、“减小”或“不变”)。
(6)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度积表达式为Ksp=。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10-5mol·L-1,需调节pH为以上。
(14分)X,Y,Z,Q,R是五种短周期元素,原子序数依次增大。X,Y两元素最高正价与最低负价代数和均为0;Q与X同主族;Z是地壳中含量最高的非金属元素,R的简单离子在同周期离子中半径最小。请回答下列问题:
(1)画出Z的原子结构示意图,工业上制取R单质的化学方程式为
(2)已知,由X,Y两种元素组成的相对分子质量最小的化合物W 3.2g在氧气中完全燃烧生成稳定化合物(常温常压下)放出178.06KJ的热量,写出W燃烧的热化学方程式
(3)由以上某些元素组成的化合物A,B,C,D有如下转化关系: (在水溶液中进行)。其中C是产生温室效应的气体;D是淡黄色固体。写出C的结构式;D的电子式
(在水溶液中进行)。其中C是产生温室效应的气体;D是淡黄色固体。写出C的结构式;D的电子式
①如果A,B均由三种元素组成,B为两性化合物,且不溶于水,则由A转化为B的离子方程式为
②如果A,B均为由以上某些元素组成的盐,则A溶液显性,原因是(用离子方程式表示)。浓度均为0.1mol/L的A,B的溶液等体积混合,混合溶液中离子浓度由大到小的顺序为。
Ⅰ.在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示,试回答下列问题:
(1)该合成路线对于环境保护的价值在于。
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂。用离子方程式表示乙醇胺水溶液呈弱碱性的原因。
(3)CH3OH、H2的燃烧热分别为:△H=-725.5 kJ/mol、△H=-285.8 kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:。
Ⅱ.将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2) / n(CO2)] |
500 K |
600 K |
700 K |
800 K |
| 1.5 |
45% |
33% |
20% |
12% |
| 2.0 |
60% |
43% |
28% |
15% |
| 3.0 |
83% |
62% |
37% |
22% |
(4)该反应的焓变△H0,熵变△S0(填>、<或=)。
(5)用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式。
(6)若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜g。
为了防止或减少机动车尾气和燃煤产生的烟气对空气的污染,人们采取了很多措施。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)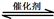 2CO2(g)+ N2(g) △H<0,
2CO2(g)+ N2(g) △H<0,
若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是(填代号)。
(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(2)机动车尾气和煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。已知:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol ①
2NO2(g) N2O4(g)ΔH=-56.9 kJ/mol ②
N2O4(g)ΔH=-56.9 kJ/mol ②
H2O(g) = H2O(l)ΔH=-44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:。
(3)用NH3催化还原NOX也可以消除氮氧化物的污染。如图,采用NH3作还原剂,烟气以一定的流速通过催化剂,通过测量逸出气体中氮氧化物含量,从而可确定烟气脱氮率,反应原理为:NO(g) +NO2(g)+2NH3(g) 2N2(g) + 3H2O(g)。
2N2(g) + 3H2O(g)。
①该反应的△H0(填“>”、“=”或 “<”)。
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),
则上述反应的KP=。
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图,石墨I为电池的极。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为。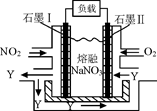
(5)硝酸工业尾气中氮氧化物(NO和NO2)可用尿素〔CO(NH2)2〕溶液除去。反应生成对大气无污染的气体。1 mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1︰1)的质量为g。