碳、硅、锗、锡、铅的单质及化合物是重要的工业材料。
(1)金刚石和石墨是碳的两种同素异形体,相同条件下石墨更稳定,则石墨转化为金刚石的反应是______(填“放热”或“吸热”)反应。
(2)SiO2在通信领域的一种重要用途是______。SiO2晶体中的基本结构单元是_____。
(3)SnCl2有较强的还原性,写出SnCl2与FeCl3溶液反应的离子方程式 。
(4)铅丹(Pb3O4)可作为防锈用涂料,呈红褐色。可采用PbS在空气中连续氧化的方法制备:PbS →PbO→Pb3O4,写出第一步氧化的化学方程式 。铅丹曾用于铁制品防锈,请说明它的主要危害 。1 mol铅丹与足量浓盐酸反应时,转移的电子数目为2 NA,写出该反应的化学方程式 。
(5)金属锗、锡在空气中不反应,铅在空气中表面生成一层氧化铅,可能的原因是: 。
【化学——选修物质结构与性质】(15分)A、B、C、D都是元素周期表中的短周期元素,它们的核电荷数依次增大。第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素,D原子的S电子与P电子数相等,E是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请用对应的元素符号或化学式回答下列问题:
(1)A、B、C的电负性由小到大的顺序为 __;D的稳定离子核外有种运动状态的电子 .
(2)A的最高价氧化物对应的水化物分子中其中心原子采取杂化。
(3)已知A、C形成的化合物分子甲与B的单质分子结构相似, 1 mol甲中含有 键的数目为。
(4)科学家发现硼化D在39K时呈超导性,在硼化D晶体的理想模型中,D原子和硼原子是分层排布的,一层D一层硼相间排列。下图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是D原子投影,黑球是硼原子投影,图中的硼原子和D原子投影在同一平面上。根据图示确定硼化D的化学式为_______。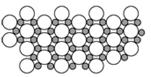
(5)E的外围电子排布式是;E的氢化物的晶体结构如下图所示,此氢化物化学式是;写出此氢化物在氯气中燃烧的化学方程式。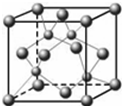
(A)(13分)在晶体中,微观粒子是有规律排布的。而实际上的晶体与理想结构或多或少会产生偏离,这种偏离称为晶体的缺陷。由于晶体缺陷,氧化铁FexO中的x常常不确定。
(1)请写出铁原子基态电子排布式。
(2)Fe2+与Fe3+相比,较稳定的是,请从二者结构上加以解释。
(3)硫氰根离子和异硫氰根离子都可用SCN-表示,碳原子都处于中央,则碳原子的轨道杂化类型为。其中异硫氰根离子与CO2是等电子体,异硫氰根离子的电子式为。Fe3+与SCN―可以形成配位数1~6的配离子,若Fe3+与SCN―以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为。
(4)如图:铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法不正确的是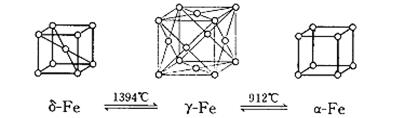
A.γ-Fe晶体中,铁原子的配位数为12
B.δ-Fe晶体和α-Fe晶体都是非密置在三维空间堆积而成的,堆积后非密置层都保持原来的结构不变
C.三种晶体的空间利用率大小为:γ-Fe晶体>δ-Fe晶体>α-Fe晶体
D.三种晶胞的棱长之比为: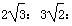 3
3
(5)FexO有NaCl结构的晶胞。今有某种FexO晶体中就存在如图所示的缺陷,其密度为5.71 g·cm-3,晶胞棱长为a=4.28×10-8cm(已知:4.283=78.4),则x=。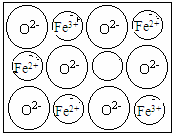
(8分)KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1h;(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;(4)利用氧化还原滴定方法,在700C-800C条件下用基准试剂(纯度高、式量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)将溶液加热并保持微沸1h的目的是。
(2)如何保证在700C~800C条件下进行滴定操作:。
(3)准确量取一定体积的KMnO4溶液用________________(填仪器名称)。
(4)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用_________(填序号)。
| A.H2C2O4·2H2O | B.FeSO4 | C.浓盐酸 | D.Na2SO3 |
(5)若准确称取Wg你选的基准试剂溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液VmL。问:
①滴定终点标志是____________________;
②所配制KMnO4标准溶液的物质的量浓度为_______________mol/ L;
(6)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将____(填“偏高”或“偏低”)。
(9分)现有A、B、C、D、E、F六种无色溶液,它们可能是:CH3COONa溶液、NH4Cl溶液、NaOH溶液、CH3COOH溶液、氨水、NaCl溶液中的某一种。已知B、D两溶液呈酸性,但B溶液中水的电离程度大于D溶液中水的电离程度;A、C、F焰色反应均为黄色,F溶液呈中性,A、C溶液呈碱性,但物质的量浓度相同时,C溶液的pH值大于A溶液的pH值。试回答下列问题:
(1)在A、C、F三种溶液中,水的电离程度由大到小的顺序为(填序号)。
(2)常温下,将等物质的量浓度,等体积的B、E两溶液相混合,所得混合溶液的pH7(填“大于”或“等于”或“小于”),溶液中各离子浓度大小关系为。
(3)常温下,若C溶液中c(OH-)与D溶液中c(H+)相等,将二者等体积混合,所得混合溶液的pH7(填“大于”或“等于”或“小于”);如果将等物质的量浓度的C、D按a:b的体积比混合,混合溶液的pH恰好等于7(体积变化忽略不计),则D的电离平衡常数为(用含a、b的表达式表示)。
(4)常温下,若B溶液中c(H+)与C溶液中的c(OH-)相等,现将B、C溶液都稀释10倍,稀释后B溶液的pH值用pHB表示,C溶液的pH值用pHC表示,则pHB+pHC14(填“等于”、“大于”或“小于”)。
(B)(8分)下表中有甲、乙两组物质,可用编号回答下列问题:
| 甲 组 |
(A)C6H5OH (B)CH3COOCH3 (C)CH3=CHCOOH (D)CH3CH2Br |
| 乙 组 |
①溴水 ②FeCl3溶液 ③NaOH溶液 ④HCHO溶液 |
(1)甲组中B只能和乙组中发生反应。
(2)甲组中和乙组中②可以发生显色反应,此反应可用于两种物质的相互检验。
(3)甲组中能与乙组中所有物质发生反应。
(4)乙组中①能与甲组中发生取代反应,发生加成反应。
(5)甲组中的一种物质和乙组中的一种物质可以发生缩聚反应生成一种粉红色线型高分子化合物,该反应的方程式为。