(9分)现有A、B、C、D、E、F六种无色溶液,它们可能是:CH3COONa溶液、NH4Cl溶液、NaOH溶液、CH3COOH溶液、氨水、NaCl溶液中的某一种。已知B、D两溶液呈酸性,但B溶液中水的电离程度大于D溶液中水的电离程度;A、C、F焰色反应均为黄色,F溶液呈中性,A、C溶液呈碱性,但物质的量浓度相同时,C溶液的pH值大于A溶液的pH值。试回答下列问题:
(1)在A、C、F三种溶液中,水的电离程度由大到小的顺序为 (填序号)。
(2)常温下,将等物质的量浓度,等体积的B、E两溶液相混合,所得混合溶液的pH 7(填“大于”或“等于”或“小于”),溶液中各离子浓度大小关系为 。
(3)常温下,若C溶液中c(OH-)与D溶液中c(H+)相等,将二者等体积混合,所得混合溶液的pH 7(填“大于”或“等于”或“小于”);如果将等物质的量浓度的C、D按a:b的体积比混合,混合溶液的pH恰好等于7(体积变化忽略不计),则D的电离平衡常数为 (用含a、b的表达式表示)。
(4)常温下,若B溶液中c(H+)与C溶液中的c(OH-)相等,现将B、C溶液都稀释10倍,稀释后B溶液的pH值用pHB表示,C溶液的pH值用pHC表示,则pHB+pHC 14(填“等于”、“大于”或“小于”)。
现有五种离子化合物 A、B、C、D 和 E,组成它们的离子有:
| 阳离子 |
K+Ag + Ba 2+ A13+Fe3+ |
| 阴离子 |
OH - C1 - SO4 2-NO3- CO32- |
为鉴别它们,分别完成以下实验,其结果是:
a. B 和 E 的水溶液均呈碱性。
b. A 溶于水后,与上述某阳离子反应生成的白色沉淀X,X既不溶于氨水也不溶于硝酸,且 A 溶液与过量氨水反应生成白色沉淀Y;
c. C 溶液与适量氨水反应生成无色溶液可与葡萄糖溶液发生银镜反应。
d. E 溶于水后,与上述某阴离子反应可生成 X;
e. A溶液与适量 E溶液反应生成白色沉淀,再加入过量 E溶液,沉淀量减少,但不消失。 请根据上述实验结果,填空:
(1)写出化合物的化学式:A,B,C。
⑵ 写出D与氨水反应的化学方程式:
⑶写出实验e中“A溶液与适量 E溶液反应生成沉淀”后“再加入过量 E溶液,
沉淀量减少”的离子方程式:。
海水中可提取多种化工原料,下面是工业上对海水的几项综合利用示意图。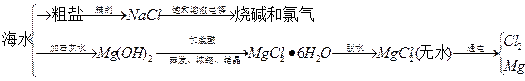
根据示意图回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,精制时所用试剂为盐 酸、BaCl2溶液、NaOH溶液、Na2CO3溶液,加入试剂的顺序是 、 、 、 。
(2)电解饱和食盐水的总反应的化学方程式为 。
(3)工业上MgCl2·6H2O晶体在 气氛中加热脱水,通入此种气体的作用是 。
一瓶澄清透明的溶液,可能含有下列离子中的一种或几种:Fe2+、Fe3+、Ba2+、Al3+、NH4+、SO42-、 HCO3-、NO3-、Cl-取溶液进行如下实验:
①溶液滴在蓝色石蕊试纸上,试纸呈红色。
②取少量溶液浓缩后加入铜片和浓硫酸共热,有红棕色气体生成。
③取少量溶液,加入用硝酸酸化的氯化钡溶液,产生白色沉淀。
④另将③中的沉淀过滤出,滤液中加入硝酸银溶液,生成白色沉淀
⑤另取原溶液,逐滴加入氢氧化钠溶液至过量,先看到生成沉淀,随之该沉淀部分溶 解,并呈红褐色。
根据上述实验现象推断:
(1)溶液中肯定存在的离子有。
(2)溶液中肯定不存在的离子有。
(3)溶液中不能确定是否存在的离子有。
(4)对上述实验操作做何改进,才能确定(3)中的离子是否存在
在试管里放入一块铜片,注入一定体积的浓硫酸,给试管加热,使之反应。
(1)若铜片还有剩余,硫酸__ __消耗完毕(填“已”或“没有”)。其理由是
。
(2)用一定量的废铜屑制取胆矾,有两种方法:第一种是取Cu与浓H2SO4直接反应;第二种是先将铜在空气中加热使之生成CuO,再与稀H2SO4反应,其中__种方法好,理由是____ ____。
将a mol的Na2O2和b mol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应。
(1)当剩余固体为Na2CO3,排出气体为O2,H2O时,a:b的值为________。
(2)当剩余固体为Na2CO3,NaOH,排出气体为O2,H2O时,a:b的值为________。
(3)当a:b>1时,剩余固体为________,排出气体为________。
(4)当排出的O2和H2O为等物质的量时,则a:b的值为________。