已知某粒子的结构示意图为
试回答:
(1)当x-y=10时,该粒子为 (填“原子”、“阳离子”或“阴离子”)
(2)写出y =3与y =7的元素最高价氧化物对应水化物间发生反应的离子方程式:
。
(3)当y=8时,粒子可能为 。
(131分)某利,盐溶解后得到的溶液中,可能含有Fe2+、Fe3+、SO42-、NH4+、Ba2+、CO32-离子中的某几种。
(1)甲同学做如下实验:①取少量溶液于试管中逐滴加人浓氢氧化钠溶液,发现先生成白色沉淀,迅速变为灰绿色,最后变为红揭色,并有刺激性气体生成;②另取少量溶液于试管中,加人少量盐酸酸化的氯化钡溶液,有白色沉淀生成。该溶液中一定含有的离子是_____;写出①中白色沉淀转化为红褐色沉淀的化学方程式__________________。
(2)乙同学做如下实验:取少量溶液于试管中,滴加几滴硫氰酸钾溶液,无明显现象;再滴加H2O2发现溶液变红色。继续滴加H2O2,红色逐渐褪去且有气泡产生。为弄清其中缘由,他查阅资料知:
①该反应中,被氧化的元素为__________,每生成1molCO2转移的电子数为___________;
②根据乙同学的实验现象,请判断还原性强弱为:Fe2+__________SCN-(填<、=或>);
③根据资料,乙同学提出的猜想是:H2O2将SCN-氧化使红色逐渐褪去。请你设计一个实验,验证乙同学的猜想是否正确_____________________________________________。
(10分)在容积为1 L的密闭容器中,进行如下反应:
A(g)+2B(g)  C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。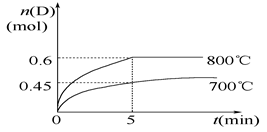
请回答下列问题:
(1)700℃时,0~5min内,以B表示的平均反应速率为_______。
(2)能判断反应达到化学平衡状态的依据是__________。
A.容器中压强不变 B.混合气体中c(A)不变
C.v正(B)=2v逆(D) D.c(A)=c(C)
(3)若最初加入1.0 mol A和2.2 mol B,利用图中数据计算在800℃时的平衡常数K=__________,该反应为__________反应(填“吸热”或“放热”)。
(4)800℃时,某时刻测得体系中物质的量浓度如下:c(A)=0.06 mol/L,c(B)=0.50 mol/L,c(C)=0.20 mol/L,c(D)=0.018 mol/L,则此时该反应__________(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③HCl溶液 ④氨水
(1)上述溶液中,可发生水解的是________(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为__________。
(3)向④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值_______(填“增大”、“减小”或“不变”)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是________________。
(5)取10 mL溶液③,然后加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________。
A、B、C、D四种短周期元素,原子序数依次增大;A和C能形成一种分子X或一种+1价阳离子Y:B元素的原子最外层电子数是次外层电子数的2倍:C、D在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体。回答下列问题:
(1)B在周期表中的位置为。
(2)写出一种由A、B、C、D四种元素组成的常见化合物的化学式,其中所含的化学键类型为。
(3)写出Y水解的离子方程式。
(4)在101 kPa时,lgX气体在D单质中充分燃烧,生成一种液态化合物和另一种对环境无污的稳定物质,放出18.6 kJ的热量。该反应的热化学方程式为。
下列有关实验的叙述中,合理的是
| A.用碱式滴定管量取25.00mL溴水 |
| B.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠 |
| C.测定溶液的pH值时用干燥、洁净的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上,再与标准比色卡比较 |
| D.圆底烧瓶、锥形瓶、烧杯加热时都应垫在石棉网上 |
E.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高
F.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸