工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已除去表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应选用 (填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为 。
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
(3)装置B中试剂的作用是 。
(4)为确认Q的存在,需在装置中添加M于 (填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(5)如果气体Y中含有H2,预计实验现象应是 。
氨气在科研、生产中有广泛应用。
(1)在三个1L的恒容密闭容器中,分别加入0.1mol N2和0.3mol H2发生反应N2(g)+3H2(g) 2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
①实验Ⅲ在前10分钟内NH3平均反应速率v(NH3)= ;
②与实验Ⅱ相比,实验Ⅲ采用的实验条件可能为 。
③K(T1)___K(T2)(填“>”、“=”或“<”)。
④下图表示随条件改变,平衡体系中氨气体积分数的变化趋势。当横坐标为压强时,变化趋势正确的是(填序号,下同)__________,当横坐标为温度时,变化趋势正确的是___________。
(2)常温下NH3•H2O的电离平衡常数Kb=1.8×10-5 mol·L-1,则反应NH4+(aq)+H2O(l) NH3•H2O(aq)+H+(aq)的化学平衡常数Kh= (保留三位有效数字)。
NH3•H2O(aq)+H+(aq)的化学平衡常数Kh= (保留三位有效数字)。
(3)工业上用NH3消除NO污染。在一定条件下,已知每还原1molNO,放出热量120kJ,请完成下列热化学方程式:NO(g)+NH3(g)=N2(g)+ (g) ΔH2= 。
香豆素是用途广泛的香料,合成香豆素的路线如下(其他试剂、产物及反应条件均省略):
(1)有机物Ⅰ中含氧官能团的名称为 ;1mol有机物Ⅳ在一定条件下与溴水反应,最多消耗溴的物质的量为 mol。
(2)反应①~④中属于加成反应的是________。
(3)香豆素在过量NaOH溶液中完全反应的化学方程式为 。
(4)Ⅴ是有机物Ⅳ的同分异构体,写出符合下列条件的Ⅴ的结构简式 。
①苯环上只有两个处于对位的取代基;
②能使氯化铁溶液呈紫色;
③能发生银镜反应和水解反应
(5)一定条件下, 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 。
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 。
甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是
反应①:CH4(g)+ H2O(g)  CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0
(1)已知:
CH4(g)+ 2O2(g)=CO2(g) + 2H2O(g)ΔH1=-802 kJ·mol-1
CO(g) + 1/2O2(g)=CO2(g)ΔH2=-283 kJ·mol-1
H2(g) + 1/2O2(g)=H2O(g)ΔH3=-242 kJ·mol-1
则反应①的ΔH =_________(用ΔH1、ΔH2和ΔH3表示)。
(2)其他条件相同,反应①在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CH4的转化率随反应温度的变化如图所示。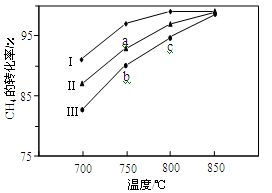
①在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是________。
②a点所代表的状态________(填“是”或“不是”)平衡状态。
③c点CH4的转化率高于b点,原因是________。
(3)反应①在恒容密闭反应器中进行,CH4和H2O的起始物质的量之比为1︰2,10 h后CH4的转化率为80%,并测得c(H2O)=0.132 mol·L-1,计算0~10 h内消耗CH4的平均反应速率(写出计算过程,结果保留2位有效数字)。
(4)在答题卡的坐标图中,画出反应①分别在700℃和850℃下进行时,CH4的转化率随时间t变化的示意图(进行必要标注)。
A、B、C、D四种化合物,有的是药物,有的是香料。它们的结构简式如下所示:
(1)D中含有的官能团的名称是 ;化合物B的分子式是 ;
(2)化合物D的核磁共振氢谱中出现 组峰;
(3)1mol A分别与足量金属钠、碳酸钠反应产生气体的体积比为 ;1molC完全燃烧消耗标准状况下氧气的体积为 ;
(4)A与乙二醇(HOCH2CH2OH)以物质的量2:1反应生成一种酯和水,请写出该反应的化学方程式(注明反应条件): 。
(5)符合下列条件的有机物C的同分异构体有___种:
①能够发生银镜反应;
②能够使FeCl3溶液显紫色;
③苯环有两个取代基
某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果。
已知:C(s)+O2(g) CO2(g) △H=-393kJ•mol-1;
CO2(g) △H=-393kJ•mol-1;
2CO(g)+O2(g) 2CO2(g) △H=-566kJ•mol-1;
2CO2(g) △H=-566kJ•mol-1;
(1)将水蒸气喷到灼热的炭上实现炭的气化(制得CO、H2),若要得到该反应的热化学方程式,还需要知道反应(用化学方程式表示) 的焓变。
(2)将一定量CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组序 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
|
| H2O |
CO |
CO2 |
|||
| 1 |
500 |
4 |
4 |
2.0 |
6 |
| 2 |
750 |
2 |
1 |
0.6 |
3 |
| 3 |
750 |
2 |
1 |
0.6 |
1 |
①500℃时该反应的平衡常数K=______________。
②该反应的逆反应为 (填“吸热”或“放热”)反应。
③实验2中,0~3min时段内,以v(H2)表示的反应速率为 。
④实验3与实验2相比,改变的条件是 。请在下图坐标中画出“实验2”与“实验3”中c(CO2)随时间变化的曲线,并作必要的标注。
(3)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用 Li2CO3和 Na2CO3的熔融盐混合物作电解质,CO 为负极燃气,空气与 CO2的混和气为正极助燃气,制得在650℃下工作的燃料电池,则负极电极反应式为 。
(4)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的电离平衡常数K= 。(已知:10-5.6=2.5×10-6)
HCO3-+H+的电离平衡常数K= 。(已知:10-5.6=2.5×10-6)