如右图,将一锌片放入1mol·L—1蓝色Cu(NO3)2溶液中,观察到下列实验现象:
①反应初期锌片上有大量气泡冒出,同时液面的上一层Cu(NO3)2溶液开始呈现绿色,并且逐渐向液面下的深处扩散,试管底部有红色固体出现。
②与锌片接触的溶液温度明显升高,反应越来越剧烈,
并在红色固体止方开始出现一层蓝色沉淀,并逐渐增多。
③反应后期溶液逐渐变为无色,试管底部又有部分白色沉淀物。
回答下列问题:
(1)反应结束时,试管底部存在的一些蓝色沉淀是什么物质
,白色沉淀可能是什么物质 ,用离子方程式表示实验中观察到的红色固体产生的原因 。
(2)有学生甲认为,反应中产生的大量气泡可能是氢气,支持这种说法的理由是 。
(3)学生乙将反应过程中产生的气体用排水法收集起来,这是一种无色气体,用爆呜法测试不能产生爆呜声 ,则学生甲的假设被推翻。学生乙又对这种无色气体进行 推测,并设计了一个简便的实验方法证实了他的推测,写出学生乙推测出的这种气体的分子式 ;验证该气体的实验方法是 。
(4)学生丙解释反应速率逐渐加快的原因时,认为除温度升高外还有一个重要因素,请问是什么因素? 。
(5)起初实验小组同学认为,溶液显绿色可能是Zn(NO3)z溶液的颜色,但学生丁将Zn(NO3)2固体溶于水后却得到无色溶液,他马上回想起该溶液的颜色与浓硝酸和铜片反应后的溶液颜色极为相似,于是他又提出了关于溶液呈绿色的一种新的假设:可能是硝酸铜溶液中溶入了一种气体,这种气体可能是 ,请设计一个简单的实验验证这种假设正确与否 。
(10分)有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液.相应的实验过程可用如图表示:
请回答下列问题: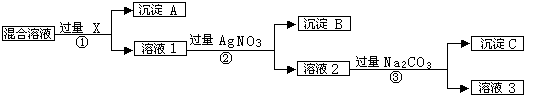
(1)写出实验流程中下列物质化学式:试剂X,沉淀A,沉淀B。
(2)①、②、③过程中均需要过滤,在进行此操作时需要用到的玻璃仪器为:、、。
(3)上述实验流程中加入过量的Na2CO3的目的是。
(4)按此实验方案得到的溶液3中肯定含有Na2CO3杂质;为了解决这个问题,可以向溶液3中加入适量的,之后若要获得固体NaNO3需进行的实验操作是(填操作名称)。
用方程式表示下列反应的原理(是离子反应的写离子方程式):
(1)除去碳酸钠固体中混有的少量碳酸氢钠:。
(2)除去FeCl2溶液中的少量FeCl3:。
(3)实验室用硫酸铝溶液与氨水制备氢氧化铝:。
(4)除去Mg粉中混有的少量Al粉:。
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度 (mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c1 |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸:_________________________________________________________。
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2 mol·L-1?______(选填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是________。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是______酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是____________。
(4)写出丁组实验所得混合溶液中下列算式的精确结果(不能做近似计算)。
c(Na+) - c(A-)= ____________mol·L-1;
c(OH-) -c(HA)= ____________mol·L-1。
密闭容器中mA(g)+nB(g)  pC(g),反应达到平衡,经测定增大压强P时,
pC(g),反应达到平衡,经测定增大压强P时,
A的转化率随P而变化的曲线如图。
则:(1)增大压强:A的转化率,平衡向 移动,达到平衡后,混合物中C的质量分数_____。
(2)上述化学方程式中的系数m、n、p的正确关系是。
(3)降低温度,C的质量分数增大,则:平衡向 移动,A的转化率,正反应是 热反应。(以上各空用适当的化学用语或关系式填写)
(1)物质的量浓度均为0.1 mol/L的下列溶液:①NH4Cl、②Na2CO3、③NaHCO3、④NaHSO4、⑤CH3COOH、⑥NaOH,pH由大到小的顺为: (填数字代号)
(2)氢气燃烧热值高。实验测得,在常温常压下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧的热化学方程式为__________________________________。
(3)常温下,0.1 mol/L的NaHCO3溶液的pH大于8,则溶液中H2CO3____ CO32-(填>、=或<),原因________________________(用离子方程式和必要的文字说明)
(4)常温下,pH=a某强酸溶液V1 L,pH=b某强碱溶液V2 L,已知a+b=12,两溶液混合后pH=7,求V1 和V2的关系
(5)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c (Na+)∶c (OH-)="________"
(6)常温下,已知Ksp(Mg(OH)2)=1.8×10-11,则Mg(OH)2在pH=12.00的NaOH溶液中的Mg2+浓度为mol·L-1