(14分)有A、B、C、D、F、G六种短周期主族元素,它们的原子序数依次增大。B元素的最高正价与最低负价的绝对值相等,D元素原子最外层电子数是次外层电子数的3倍,F元素在地壳中含量居第二位;A与B、C、D分别构成电子数相等的分子Q、X、Y;化合物AG在空气中与X反应产生白烟Z。
请回答下列问题:
G的原子结构示意图为 ,A2D2电子式为 ,
BD2的结构式为 ,Q的分子空间结构为 。
(2)固体Z为 晶体(填晶体类型),Z中所含化学键类型有 。
(3)在D同主族元素氢化物中,Y的沸点反常,原因是 。
(4)B、F、G元素非金属性由强到弱的顺序为 ,若用下图装置验证这三种元素非金属性强弱,则在装置中加入的试剂分别为:Ⅰ ,Ⅱ ,Ⅲ 。(填化学式)
已知:
RCH2COOH+Br2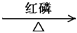 RCH(Br)COOH+HBr(R为烃基)
RCH(Br)COOH+HBr(R为烃基)
有一常用于香料工业的芳香族化合物名叫桂酸叶酯。其合成路线如下图所示: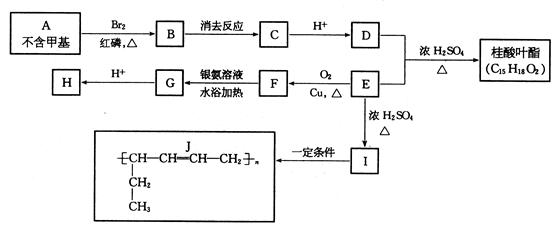
试回答:(1)I的结构简式是;
E分子含有的官能团是(写名称);
(2)BgC的反应条件是; FgG反应类型(填编号);
a. 还原反应 b. 氧化反应 c. 取代反应 d. 消去反应
(3)A的结构简式是;
(4)写出下列化学方程式:
EgF;
D发生的加聚反应;
(5)写出桂酸叶酯的结构简式:。
(6)E的同分异构体中属于醛类且分子中含有3个甲基的结构有_______种。
工业上可以利用氟硅酸、碳酸氢铵制备冰晶石(Na3AlF6),其工艺如下:
请回答下列问题:
(1)反应①中生成的无色气体A是,滤液①的溶质是。
(2)经测定NH4HCO3溶液呈中性,请分析原因(用离子方程式和文字表述说明理由)
。
(3)经反应②后,过滤得到的冰晶(Na3AlF6)固体,该固体上附着有杂质,需要洗涤,请简述如何证明冰晶石固体已经洗涤干净。
(4)温度和NH4HCO3浓度会影响反应①的速率。现设计如下实验方案探究温度和NH4HCO3浓度对反应①速率的影响。请在表格空白处填写适当的反应条件。
| 实验编号 |
实验目的 |
温度 |
c(NH4HCO3) |
| I |
为以下实验作参照 |
60℃ |
c1 |
| II |
探究浓度对反应①速率的影响 |
c2 |
|
| III |
探究温度对反应①速率的影响 |
80℃ |
(5)下图是滤液①溶质的质量分数随温度变化的曲线图: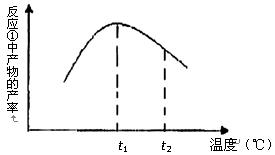
请分析t1到t2曲线下降的原因是。
(12分)A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图(反应条件和部分产物略去)。试回答:
(1)E的电子式是。
(2)单质X和B或D均能反应生成黑色固体Y,Y的化学式是。
(3)物质Z常用于对空气进行杀菌、净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是。
(4)取0.3 mol F与足量D充分混合后,所得溶液中再通入0.2 mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H+)。
(5)E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,101 kPa时,该反应的热化学方程式是。
(已知甲醇的燃烧热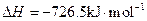 ,氢气的燃烧热
,氢气的燃烧热 )
)
[选修—有机化学基础]
有机物A、H、O分子式相同,经测定相对分子质量不超过110。分子中只含C、H、O三种元素,碳的百分含量为60%,其中A能发生银镜反应。A的碳链无支链;B分子中只有五元环。有关的转化关系如图24的示。请回答下列问题:
(1)写出B的结构简式;1分子核磁共振氢谱中有3种峰,其峰面积之比为1:2:1,I的名称是。
(2)写出C—E反应类型是;F—G的反应类型是。
(3)写出D—C、G—H的化学反应方程式。
D—C;
G—H。
(4)写出与B属地同分异构体,分子中有一个五元环且能与银氨溶液反应的结构简式
。
[选修—物质结构与性质]
羰基铁[Fe(CO)5]会使合成甲醇和合成氨等生产过程中的催化剂中素。请回答下列问题:
(1)Fe(CO)5中铁的化合价为0,写出铁原子的基态电子排布式。
(2)CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO分子中C原子的杂化类型为杂化。与CO分子互为等电子体的分子和离子各写出1种,分别为和(填化学式),CO分子的结构式可表示为。
(3)Fe(CO)5常温下呈液态,熔点为—20.5℃,沸点为103℃,易溶于非极性溶剂。据此可以判断Fe(CO)5晶体为。
(4)科学家通过X射线探明,FeO、MgO、CaO的晶体结构与NaCl的晶体结构相似(如23所示)①比较晶体熔点的高低MgOCaO(填“高于”或“低于”)
②若在FeO晶体中阴阳离子间最近距离为a cm,晶体密度为dg/cm3。则阿伏伽德罗常数NA表达式为mol-1。