(15分)微粒A、B、C为分子,D和F为阳离子,E为阴离子,它们都含有l0个电子;B溶于A后所得的物质可电离出D和E;C是重要的化石能源。将A、B和含F离子的物质混合后可得D和一种白色沉淀。G3+离子与Ar原子的电子层结构相同。请回答:
⑴基态G原子的外围电子排布式是 。在A、B、C这三种分子中,属于非极性分子的有 (写化学式)。
⑵下列有关B的说法中正确的是 。(填字母)
a.在配合物中可作为配体
b.该分子的稳定性与氢键有关
c.分子中各原子最外层均为8e-的稳定结构
d.含1 molB的液体中有3mol氢键
⑶根据等电子体原理,D离子的空间构型是 ,其中心原子轨道的杂化类型是 。
⑷构成C的中心原子可以形成多种单质,其中有一种为空间网状结构,上图立方体中心的“●”表示该晶体中的一个原子,请在该立方体的顶点上用“●”表示出与之紧邻的原子。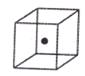
⑸光谱证实F与烧碱溶液反应有Na[F(OH)4]生成,则Na[F(OH)4]中不存在 。(填字母)
a.金属键 b.离子键 c.非极性键 d.极性键 f.配位键 g.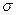 键 h.
键 h.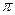 键
键
某研究性学习小组设计两套实验方案制备氨气并探究其还原性(部分夹持装置已省略)。
甲方案:如图所示。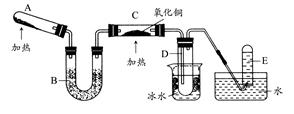
乙方案:如图所示。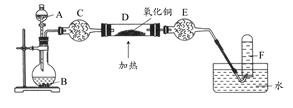
根据方案回答下列问题:
(一)甲方案
(1)B装置盛装碱石灰,A装置中药品可以是。
a.氯化铵固体和烧碱 b.碳酸氢铵固体
c.氯化铵固体 d.硫酸铵和熟石灰
(2)实验完毕后,设计简单实验检验D试管收集到的物质(简述操作过程、现象和结论)。
(3)写出C中发生反应的化学方程式。
(二)乙方案
(4)A为浓氨水,B为生石灰,简述实验原理:。E装置里盛装的药品是。
(5)能证明氨气具有还原性的实验现象。(任写两条)
(6)铜有+2价、+1价、0价,根据氧化还原反应原理,D玻璃管里还原产物除铜外,还可能有,假设有铜以外的还原产物生成,写出D中发生反应的化学方程式:。
请回答下列实验室中制取气体的有关问题。
(1)如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。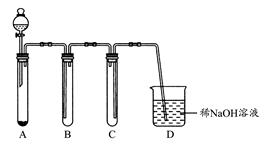
装置B,C,D的作用分别是:B;C;D。
(2)在实验室欲制取适量NO气体。
①下图中最适合完成该实验的简易装置是(填序号);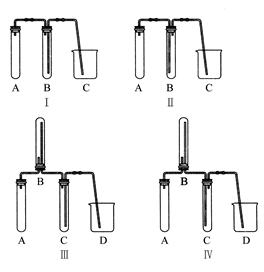
②根据所选的装置完成下表;(不需要的可不填)
| 应加入的物质 |
所起的作用 |
|
| A |
||
| B |
||
| C |
||
| D |
③简单描述应观察到的实验现象。
某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。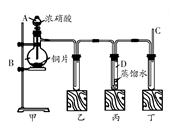
请回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是,该装置中发生反应的化学方程式为。
(2)实验过程中,装置乙、丙中出现的现象分别是;装置丙中的试管内发生反应的离子方程式为。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加KSCN溶液,溶液变为色。
某学生用实验室常见的酸、碱、盐和金属单质为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的装置。试回答: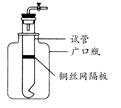
(1)若试管中装有铜丝网隔板,利用该装置可制取哪些气体?
(写出两种)。
(2)若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体?。该反应的离子方程式是:。
下表是实验室制备气体的有关内容:
| 编号 |
实验内容 |
实验原理 |
气体发生装置 |
| ① |
制氧气 |
H2O2―→O2 |
|
| ② |
制氨气 |
NH4Cl―→NH3 |
|
| ③ |
是氯气 |
HCl―→Cl2 |
(1)上表气体中:从制备过程看,必须选择合适的氧化剂才能实现的是________(填气体的化学式,下同);从反应原理看,明显不同于其他两种气体的是________。
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上表中的空格中。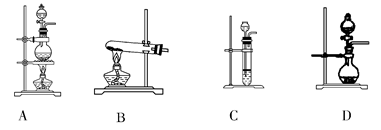
(3)若用上述制备O2的装置制备NH3,则选择的试剂为________________。
(4)制备Cl2需用8 mol·L-1的盐酸100 mL,现用12 mol·L-1的盐酸来配制。
①为提高配制的精确度,量取浓盐酸的仪器可选用下列中的________(填序号):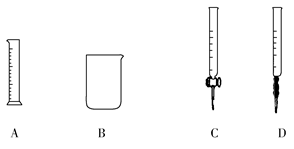
②配制过程中,除上图所列仪器外,还需要的仪器有________、________、________。