现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
最外层电子占核外电子总数的3/8[来 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z |
元素最高正价是+7价 |
(1)元素X的一种同位素可测定文物年代,其中子数为8,则这种同位素的符号是 。
(2) Y的氢化物与Y的最高价氧化物的水化物反应生成的物质名称为:
(3)T与X形成的常见化合物的结构式为:
(4)Z所在族元素的四种氢化物水溶液中,酸性最弱的物质的化学式为:
(5)T的同主族短周期元素M,M的氢化物与T的氢化物比较,沸点较高的是(填化学式) ,请解释原因:
(16分)用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下(部分操作和条件略):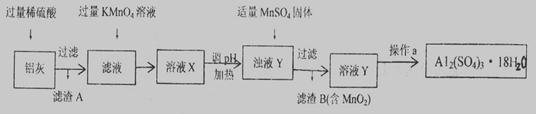
已知:一定条件下,MnO4 可与Mn2+反应生成MnO2
可与Mn2+反应生成MnO2
(1)稀H2SO4溶解Al2O3的离子方程式是__________________。
(2)已知:生成氢氧化物沉淀的pH如下表(注:金属离子的起始浓度为0.1mol·L-1)
上述流程中,加入过量KMnO4溶液的作用是________________________。(用离子方程式表示)
(3)向滤渣B中加入浓盐酸并加热,能说明沉淀中存在MnO2现象是____________。
上述流程中加入MnSO4体的目的是________________________。
操作a由一系列操作组成,分别是________、________、过滤。
(4)若用沉淀溶解平衡原理分析,操作a能析出A12(SO4)3·18H2O的原因是①____________②___________________
(17分)氢气和氨气都属于无碳清洁能。
(1)某些合金可用于储存氢,金属储氢的原理可表示为:M(s)+xH2 MH2x(s)△H<0(M表示某种合金)
MH2x(s)△H<0(M表示某种合金)
下图表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系。则下列说法中,正确的是_____________
a.T1>T2
b.增大氢气压强,加快氢气的吸收速率
c.增大M的量,上述平衡向右移动
d.在恒温、恒容容器中,达平衡后充入H2,再次平衡后的压强增大
(2)以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如装置甲所示),其中负极通入H2,正极通入O2和CO2的混合气体。乙装置中a、b为石墨电极,电解过程中,b极质量增加。
①工作过程中,甲装置中d电极上的电极反应式为_____________________________。
②若用该装置电解精炼铜,则b极接____(填“粗铜”或“精铜”);若用该装置给铁制品上镀铜,则____(填“a”或“b”)极可用惰性电极(如Pt电极),若电镀量较大,需要经常补充或更换的是_______。
(3)氨在氧气中燃烧,生成水和一种空气组成成分的单质。
已知:N2(g)十3H2(g)  2NH3(g)△H=
2NH3(g)△H= 92.4kJ·mol-1
92.4kJ·mol-1
2H2(g)十O2(g)=2H2O(1)△H= 572KJ·mo1-1
572KJ·mo1-1
试写出氨气在氧气中燃烧生成液态水的热化学方程式___________________。
(4)在一定条件下,将lmotN2和3molH2混台于一个10L的密闭容器中发生反应:
N2(g)十3H2(g)  2NH3(g)
2NH3(g)
5min后达到平衡,平衡时氮气的转化率为 。
。
①该反应的平衡常数K=________,(用含 的代数式表示)
的代数式表示)
②从反应开始到平衡时N2的消耗速率v(N2)=____mo1·L-1·min-1。(用含 的代数式表示)
的代数式表示)
(15分)I(10分)A、B、C、D均为中学化学中常见的物质,它们之间转化关系如下图(部分产物已略去):
试回答:
(1)若D是具有氧化性的单质,则属于主族的金属A为___________(填元素符号)
(2)若D是金属,C溶液在储存时应加人少最D,其理由是(用必要的文字和离子方程式表示)_____________________;
(3)若A、B、C为含同一种金属元素的无机化合物.在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子力程式_________________________________________。化合物B经过一系列反应可以得到单质E,将一定质量的Mg和E的混合物投人500m1稀硫酸中,固体全部溶解并产生气体。待反应完全后.向所得溶液中加人NaOH溶液,生成沉淀的物质的是与加人溶液的体积关系如下图所示。则固体混合物中Mg的质量为_____________;NaOH溶液的物质的量浓度为___________。
II(5分)某一离子反应体系有反应物和产物共以下六种:
已知该反应中的H2O2只发生如下过程: 
(1)该反应中的还原剂是___________。
(2)该反应中发生还原反应的过程是_____→_____。
(3)溶液随着酸性的增强氧化性不断增强,应选择__________(选填“稀硫酸”或“浓盐酸”)进行KMnO4溶液的酸化。
(4)如反应转移了0.6mo1电子,则产生的气体在标准状况下体积为__________。
(131分)某利,盐溶解后得到的溶液中,可能含有Fe2+、Fe3+、SO42-、NH4+、Ba2+、CO32-离子中的某几种。
(1)甲同学做如下实验:①取少量溶液于试管中逐滴加人浓氢氧化钠溶液,发现先生成白色沉淀,迅速变为灰绿色,最后变为红揭色,并有刺激性气体生成;②另取少量溶液于试管中,加人少量盐酸酸化的氯化钡溶液,有白色沉淀生成。该溶液中一定含有的离子是_____;写出①中白色沉淀转化为红褐色沉淀的化学方程式__________________。
(2)乙同学做如下实验:取少量溶液于试管中,滴加几滴硫氰酸钾溶液,无明显现象;再滴加H2O2发现溶液变红色。继续滴加H2O2,红色逐渐褪去且有气泡产生。为弄清其中缘由,他查阅资料知:
①该反应中,被氧化的元素为__________,每生成1molCO2转移的电子数为___________;
②根据乙同学的实验现象,请判断还原性强弱为:Fe2+__________SCN-(填<、=或>);
③根据资料,乙同学提出的猜想是:H2O2将SCN-氧化使红色逐渐褪去。请你设计一个实验,验证乙同学的猜想是否正确_____________________________________________。
(10分)在容积为1 L的密闭容器中,进行如下反应:
A(g)+2B(g)  C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。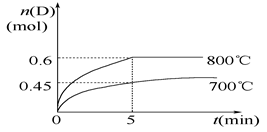
请回答下列问题:
(1)700℃时,0~5min内,以B表示的平均反应速率为_______。
(2)能判断反应达到化学平衡状态的依据是__________。
A.容器中压强不变 B.混合气体中c(A)不变
C.v正(B)=2v逆(D) D.c(A)=c(C)
(3)若最初加入1.0 mol A和2.2 mol B,利用图中数据计算在800℃时的平衡常数K=__________,该反应为__________反应(填“吸热”或“放热”)。
(4)800℃时,某时刻测得体系中物质的量浓度如下:c(A)=0.06 mol/L,c(B)=0.50 mol/L,c(C)=0.20 mol/L,c(D)=0.018 mol/L,则此时该反应__________(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。