过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
Ⅰ.测定过氧化氢的含量
步骤如下并填写下列空白:
(1)将10.00 mL密度为ρ g/mL的过氧化氢溶液稀释至250mL。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,作被测试样。此过程中需要用到的定量仪器 。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请完成该反应方程:___MnO4- + __H2O2 + ___H+ → ___Mn2+ + __H2O + __ _____
(3) 滴定时,将高锰酸钾标准溶液注入滴定管中,滴定到达终点的现象是_____________________ ___。
(4)重复滴定二次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为___________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果____(填“偏高”“偏低”“不变”)。
Ⅱ.探究过氧化氢的性质
该化学小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、二氧化锰,实验仪器及用品可自选。)
请将他们所选的实验试剂和实验现象填入下表:(只要完成其中一项探究即可)
| 实 验 内 容 |
实 验 试 剂 |
实 验 现 象 |
| 探究氧化性 |
|
|
| 或探究不稳定性 |
|
|
BAD是一种紫外线吸收剂,其合成方法如下:
已知:
Ⅰ、B分子中所有H原子的化学环境相同;
Ⅱ、BAD的结构为: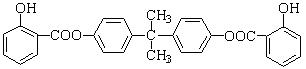 。
。
请回答下列问题:
⑴ A的名称为。
⑵ F的结构简式为。F的一些同分异构体能使氯化铁溶液变色,能发生银镜反应,且苯环上的一硝基取代产物有两种。符合上述条件的同分异构体有种。
⑶ 反应②的化学方程式为;反应③在一定条件下能直接进行,其反应类型为。
⑷ G是一种氨基酸,且羧基和氨基处于苯环的对位。写出G缩聚产物可能的结构简式(只要求写一种)。
下图是工业生产硝酸的流程。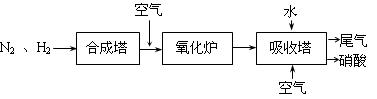
合成塔中内置铁触媒,氧化炉中内置Pt-Rh合金网。请回答下列问题:
⑴ 1909年化学家哈伯在实验室首次合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下:
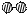 、
、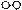 、
、 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是。
⑵ 合成氨反应的化学方程式为N2(g)+3H2(g) 2NH3(g),写出该反应的化学平衡常数表达式K=
2NH3(g),写出该反应的化学平衡常数表达式K=
。在一定温度和压强下,将H2和N2按3∶1(体积比)混合后进入合成塔,反应达到平衡时,平衡混合气中NH3的体积分数为15%,此时H2的转化率为。
⑶ 已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266.8 kJ/mol
N2(g)+O2(g)=2NO(g)△H=+180.5 kJ/mol
氨催化氧化的热化学方程式为。
⑷ 吸收塔中通入空气的目的是。
下图是中学化学中常见物质之间的相互转化关系。其中C可用于漂白,空气中M含量增加会导致温室效应。反应③常用于实验室制取气体B。
请回答下列问题:
⑴ C的分子式为 ,J的电子式为 。
⑵ 写出反应①的离子方程式 。
⑶ 写出反应②的化学方程式 。
⑷C、M有相似的化学性质,但也有区别,如C有漂白性、M五漂白性。C、M具有其他不同化学性质的原因是 。
某有机化合物D,其相对分子质量为166,取8.3g该物质完全燃烧得到CO2与H2O的物质的量之比是9:5。回答下列问题:
(1)D的分子式为:;
(2)已知其分子结构中含有一个苯环,苯环的两个邻位有取代基。进一步实验可知:
①D能与碳酸氢钠溶液反应生成无色无味气体。②8.3gD物质与足量金属钠反应可生成氢气1.12L(标准状况)。③D不能与FeCl3溶液发生显色反应。④D不能发生消去反应。请写出符合上述条件的D的所有同分异构体的结构简式:
(3)已知D的一种同分异体有以下转化关系。取C在NaOH水溶液中反应后的混合液,加入足量硝酸酸化后,再加入硝酸银溶液,出现白色沉淀。E分子中有两个六元环结构。
①A的结构简式为;
②上述转化过程中涉及到的反应类型有(填选项);
| A.氧化反应 | B.加成反应 | C.取代反应 | D.聚合反应 |
③写出由A→B的化学方程式:;
写出由D→E的化学方程式:。
某研究性学习小组从网上查到绿矾(FeSO4·7H2O)受热分解的方程式为:
2FeSO4·7H2O Fe2O3+SO3↑SO3↑+14H2O↑,就设计了如下实验装置来验证绿矾受热分解是否发生上述反应。
Fe2O3+SO3↑SO3↑+14H2O↑,就设计了如下实验装置来验证绿矾受热分解是否发生上述反应。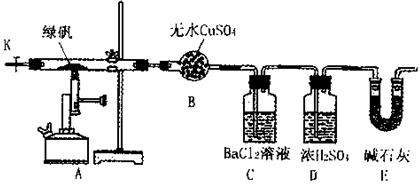
主要实验步骤如下:
①组装仪器并检查装置的气密性;
②称量绿矾样口及U型干燥管E的质量,将称量后的绿矾置于硬质玻璃管内;
③关闭活塞K,加强热使绿矾完全分解;
④打开活塞K,缓缓鼓入一定量的氮气;
⑤再次称量干燥管E的质量;
⑥重复④⑤的操作,直到干燥管E的质量基本不变为止;
⑦称量洗气瓶C中所得沉淀的质量。
试回答:
(1)洗气瓶D中浓H2SO4的作用为:;
(2)步骤⑦从溶液中获取生成沉淀质量的具体操作为:;
(3)实验小组的报告如下,请补充完整:
| 实验记录 |
分析或计算结果 |
|
| 现象 |
硬质管内绿色变为红棕色; |
生成物有 |
| 干燥管B中晶体白色变蓝色。 |
生成物有H2O |
|
| 数据 |
称取绿矾样品16.68g; |
反应的绿矾0.06mol |
| 干燥管E最后增重2.24g; |
生成SO2mol |
|
| C中生成白色沉淀的质量为4.66g; |
生成DO3 0.02mol |
(4)该实验所得到的数据与所样到的化学方程式中的定量关系不相符合,请分析可能的原因。
(5)为达到“验证绿矾受热分解是否发生上述反应”的目的,该实验的设计有多处不妥,请提出改进建议(两条即可)