下表中的数据是破坏1 mol物质中的化学键所吸收的能量(kJ)。这一数据的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热,反应热等于反应中断裂旧化学键消耗的能量之和与反应中形成新化学键放出的能量之和的差。
| 化学键 |
Cl2 |
Br2 |
I2 |
HCl |
HBr |
HI |
H2 |
| 能量(kJ) |
243 |
193 |
151 |
432 |
366 |
298 |
436 |
回答下列问题:
(1)在HCl、HBr、HI中,最稳定的是__________;
(2)对于反应X2 + H2=2HX(X2代表Cl2、Br2、I2),相同条件下,消耗等量氢气时,放出热量最多的是__________;
(3)反应Br2 + H2=2HBr,当生成1mol HBr时放出_________ kJ能量。
【化学一选修3:物质结构与性质】
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
(1)A基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈
形
(2)某同学根据上述信息,所画的B电子排布图如图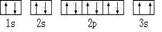
违背了 原理。
(3)F位于 族 区,其基态原子有 种运动状态。
(4)CD3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其分子空间构型为 .检验E元素的方法是
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 .
【化学-选修2:化学与技术】
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。请回答下列问题:
(1)天然水中溶解的气体主要有__________、__________。
(2)天然水在净化处理过程中加入的混凝剂可以是,其净水作用的原理是_____。
(3)水的净化和软化的区别是__________。
(4)硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO)。若某天然
水中c(Ca2)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L,则此水的硬度为
_________。
(5)若(4)中的天然水还含有c(HCO3-)=8×10-4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2__________g,后加入Na2CO3___________g。
“神七”登天标志着我国的航天事业进入了新的篇章。
(1)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。已知:
N2(g) + 2O2(g) =2NO2(g) △H =" +67.7" kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) △H = -534.0 kJ·mol-1
NO2(g)  1/2N2O4(g) △H = -26.35 kJ·mol-1
1/2N2O4(g) △H = -26.35 kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
_______________________________________________________________________。
(2)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,
燃料电池放电时的负极反应为:___________________________________。
如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标况),则该段时间内水电解系统中转移电子的物质的量为______________mol。
(3)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH——4e— = O2↑+2H2O,则阴极反应为:____________________________。
有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行?_______,理由是:___________________________________。
A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示的反应关系(反应物和生成物均无省略)。
请回答下列问题:
(1)图1所示转化过程中包含的反应类型有(填字母)。
a.置换反应 b.复分解反应 c.分解反应 d.化合反应
(2)图1中反应①的化学方程式是。
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处于平衡状态时,下列措施中有利于提高C的平衡转化率的是(填字母)。
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l.00 mol甲和2.00 mol C混合充入容积为2 L的密闭容器中,3分钟后反应达到平衡。平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为
mol•L-1•min-1。
(5)容积均为2 L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如下表所示:
| 容器编号 |
n(甲) |
n(C) |
n (D) |
v正与v逆的关系 |
| Ⅰ |
0.20 |
0.10 |
0.20 |
v正=v逆 |
| Ⅱ |
0.20 |
0.40 |
1.00 |
②? |
| Ⅲ |
0.60 |
1.20 |
0.80 |
③? |
①若方程式系数为最简整数比,则该温度下的平衡常数K=
填写表中空格:②③
(化学-有机化学基础)A、B、C、D四种芳香族化合物的结构简式如下所示:
请回答下列问题:
(1)D中含氧官能团的名称为。
(2)用A、B、C、D填空:能发生银镜反应的有;既能与FeCl3溶液发生显色反应又能与Na2CO3溶液反应放出气体的是。
(3)按下图C经一步反应可生成E,E是B的同分异构体,
则反应①的反应类型为;写出反应②的化学方程式:。
(4)G、H和D互为同分异构体,它们具有如下特点:
① G和H是苯的二元取代物,这两个取代基分别为羟基和含有-COO-结构的基团;
② G和H苯环上的一氯代物有两种不同结构;
③ G可以发生银镜反应,H分子中苯环不与取代基碳原子直接相连。
写出G和H的结构简式:G:;H:。