某兴趣小组用废铁泥(主要成分为Fe2O3、FeO和少量Fe)制备磁性Fe3O4纳米材料的流程示意图如下:

|
 ,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。
,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。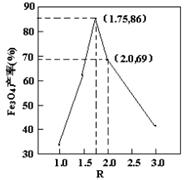
(11分)3-对甲苯丙烯酸甲酯是一种用于合成抗血栓药的中间体,其结构简式如下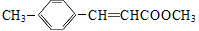
(1)下列关于3-对甲苯丙烯酸甲酯的说法,正确的是________
a.该物质的分子式为C11H12O2
b.该物质属于芳香族化合物,是苯甲酸的同系物
c.1mol该物质最多能与5mol H2发生加成反应
d.该物质能与溴发生取代反应、加成反应
(2)3-对甲苯丙烯酸甲酯可由下列合成路线获得:
①某学生判断A可以是高锰酸钾溶液,你认为该同学判断_____(填“正确”或“错误”)。
②化合物I可由芳香族化合物Ⅲ和Ⅳ分别通过消去反应获得,Ⅲ和Ⅳ两物质只有Ⅳ能与钠反应产生氢气,则Ⅳ的结构简式可能是______(只写一种即可);由Ⅲ生成I还需提供的反应试剂为______。
③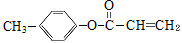 是化合物Ⅱ的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为_____________________。
是化合物Ⅱ的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为_____________________。
④化合物Ⅴ也是化合物II的一种同分异构体,已知化合物Ⅴ能同时满足如下条件:a.苯环上有两个取代基;b.苯环上一氯代物只有一种;c.不能发生银镜反应;d.不能使溴的四氯化碳溶液褪色。则化合物Ⅴ的结构简式为______________。
(9分)A~G有以下转化关系: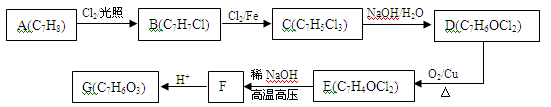
已知:①E能发生银镜反应;
②C中苯环上有三个互不相邻的取代基
③G分子遇氯化铁溶液显紫色。
(1)B的结构简式为_______________,G的结构简式为________________。
(2)C→D的反应类型是____________,E分子中含氧官能团的名称是_______________。
(3)B物质有许多同分异构体,除B外其他三种含有苯环的同分异构体的结构简式分别为
_________________、________________、__________________。
(4)D→E的化学方程式为___________________________。
(6分)某有机化合物A的相对分子质量(分子量)大于100,小于110。经分析得知,其中C和H的质量分数之和为53.8%,其余为氧。请回答:
(1)1个A分子中含有_______个氧原子,该化合物的相对分子质量是____________。
(2)已知A分子中C、H原子个数比=1:2,则A的分子式是_______。
(3)已知A可与碳酸钠溶液反应生成二氧化碳,A的核磁共振氢谱为3组峰,且面积比为6:1:1,则A的结构简式为_______________。
(6分)(1)相同物质的量的①C2H4②C2H6O完全燃烧,消耗氧气物质的量关系为______(填编号,用“>”或“=”表示)。
(2) 的分子式为______________。
的分子式为______________。
(3)在1个 分子中,处于同一平面上的原子数最多可能有____个。
分子中,处于同一平面上的原子数最多可能有____个。
(4)1mol醛基与足量银氨溶液完全反应生成Ag的物质的量为________。
(5)高聚物 的单体为__________、___________。
的单体为__________、___________。
聚合氯化铝铁(PAFC)是一种高效净水剂,其组成可表示为[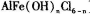 ]。
]。
为检测PAFC中Al的含量,采用下图所示流程。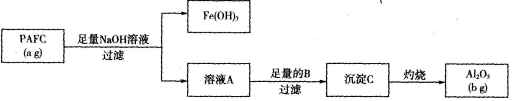
(1)PAFC中铁元素的化合价为_______.
(2)溶液A中含铝元素的溶质是______,它属于____(填“酸”、“碱”、“盐”)。
(3)如图所示,过滤操作中的一处错误是__________________.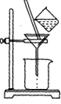
(4)物质B可能是下列试剂中的_______(填代号)。
a.NH3b.CO2c.NaOH溶液d.HNO3溶液
判断流程中沉淀C是否洗净的方法是______________________(描述操作、现象和结论)。
(5)PAFC中A1元素的质量分数为____________(用含有a、b的代数式表示)。