甲醇是一种可再生能源,具有广泛的开发和应用前景。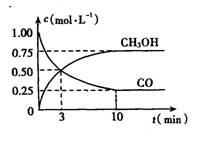
(1)工业上一般采用如下反应合成甲醇:
CO(g)+2H2(g) CH2O H(g)△H= xkJ/mo①右图是反应时CO和CH3 0H的浓度随时间的变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=__ __。
②下表所列数据是该反应在不同温度下的化学平衡
常数(K)
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断x 0(填“<”、“<”填“=”)
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得
c(CO)=0.2mol/L,则CO的转化率为____。
(2)已知在常温常压下
①2CH3OH(1)+3O2(g) 2CO2(g)+4H2O(g) △H=—1275.6kJ/mol
②2CO(g)+O2(g) 2CO2(g)△H=—566.0kJ/mol
③H2O(g) H2O(1) △H=—44.0kJ/mol
请计算1mol甲醇不完全燃烧生成lmolCO和液态水放出的热量为____。
(3)利用甲醇燃料电池设计如右图所示的装置:
则该装置中b为____极;Cu极的电极反应式为____。
当铜片的质量变化为25.6g时,a极上消耗的O2在标准状况下的体积为_ __L。
(1)I.短周期某主族元素M的电离能情况如图(A)所示,则M元素位于周期表的第____族;
Ⅱ.图B折线c可以表达出第____________族元素氢化物的沸点的变化规律。两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:________________(填“a”或 “b”);
Ⅲ.部分有机物的熔沸点见下表:
根据物质结构理论,由这些数据你能得出的相关结论是(至少写2条):____________________;
(2)COCl2俗称光气,分子中C原子采取__________杂化成键;其中碳氧原子之间共价键含有___________(填字母):
a.2个σ键
b.2个π键
c.1个σ键.1个π键;
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布式为_________________________;
Ⅱ.已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现产生的沉淀质量关系为:绿色晶体为紫色晶体的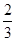 ,则绿色晶体配合物的化学式为_________________________。
,则绿色晶体配合物的化学式为_________________________。
1 mol仅含C、H、O三种元素的有机物A在稀硫酸中水解生成1 molB和1 molC。B分子中N(C)∶N(H)=4∶5,135<Mr(B)<140;C与B分子中C原子数相同,且Mr(B)=Mr(C)+2。
(1)C的分子式为 ,A的摩尔质量为 ;
(2)B的分子具有高度对称性,苯环上的一氯取代物只有一种。B能与金属Na反应但不能与NaOH反应。写出B的结构简式 ;
(3)C有多种同分异构体,其中属于酯类的同分异构体有 _______种;
(4)C分子中苯环上有两个取代基,且苯环上的一氯取代物有两种。写出A的结构简式 。
(1)写出砷的元素符号 ,原子中所有电子占有__________个轨道,核外共有_________个不同运动状态的电子。
(2)写出Ni的元素名称 ,该元素在周期表的位置为第 周期,第 族。
(3)第四周期基态原子中未成对电子数最多的元素是 ,该元素基态原子的价电子轨道表示式为 。
(4)第三电子层上有__________个能级,作为内层最多可容纳_________个电子,作为最外层时,最多可含有__________个未成对电子。
如图是可用于测量阿伏加德罗常数的装置示意图,其中A是纯铜片、B是石墨,插在100mLCuSO4稀溶液中,铜片、石墨与引出导线相连,引出端分别为X、Y。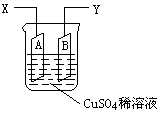
(1)当以IA的电流电解6min后,测得铜片A质量减少2.56g,则图装置中的X端应与直流电的 极相连。
(2)电解后将电源反接,2IA的电流电解6min后,假设溶液体积不变,测得溶液中CuSO4物质的量浓度为0.1mol/L,则原溶液中CuSO4物质的量浓度 mol/L。溶液中H+的物质的量浓度为 mol/L。
(3)列式计算实验测得的阿伏加德罗常数NA(用I表示) mol-1。(已知电子电量e=1.60×10–19C)
下图为Zn-Cu原电池的示意图,请回答:
(1)锌片为原电池的 (填“正”或“负”)极,该极的电极反应式是 。该反应属于 (填“氧化”或“还原”)反应。
(2) (填“电子”或“电流”)从锌片通过导线流向铜片,溶液中 的从 (填“锌片”或“铜片”)获得电子。
的从 (填“锌片”或“铜片”)获得电子。
(3)原电池工作一段时间后, 溶液的浓度(填“增大”或“减小”,下同),烧杯中溶液的质量 。
溶液的浓度(填“增大”或“减小”,下同),烧杯中溶液的质量 。
(4)若锌片质量减轻6.5g,则另一极放出气体的体积为 L(标准状况)。