1molC4H10在氧气中完全燃烧,120℃时将气体产物作如下处理,试回答:
(1)若将气体先通过浓硫酸再通过碱石灰,则浓硫酸将增重____g,碱石灰将增重___g。
(2)若将气体通过碱石灰,则碱石灰将增重______g。
(3)若将气体通过过氧化钠,则过氧化钠将增重_______g。
硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而形成。某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。请填写以下空白:
【提出问题】Na2S2O3是否与Na2SO4相似具备下列性质呢?
猜想①: 。
。
猜想②:溶液呈中性,且不与酸反应。
猜想③:无还原性,不能被氧化剂氧化。
【实验探究】基于上述猜想②、③,设计实验方案。请填写下列表格中的(1)(2)(3)。
| 实验操作 |
实验现象或预期实验现象 |
现象解释 (用离子方程式表示) |
|
| 猜想② |
(1) |
溶液pH=8 |
——— |
向pH=2的 硫酸中滴加Na2S2O3溶液 硫酸中滴加Na2S2O3溶液 |
(2) |
S2O32—+2H+=S↓+SO2↑+H2O |
|
| 猜想③ |
向新制氯水(pH<2)中滴加少量Na2S2O3溶液 |
氯水颜色变浅 |
(3) |
【实验结论】Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似。
【问题讨论】
(1)甲同学向探究“猜想③”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由。
(2)请重新设计一个实验方案,证明Na2S2O3被氯水氧化。该实验方案是。
电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。有关反应为:2FeCl3+Cu=2FeCl2+CuCl2。
现将一块敷有铜箔的绝缘板浸入8.00×102 mL某FeCl3溶液A中,一段时间后,将该线路板取出,向所得溶液B中加入铁粉m g,充分反应后剩余固体n g;将固体滤出并从滤液C(忽略反应前后溶液体积变化)中取出20.00mL,向其中滴入
3.00mol • L-1AgNO3溶液60.00 mL时,溶液中的Cl-恰好完全沉淀。请计算:
(1)溶液A中FeCl3的物质的量浓度为___________________;
(2)假若铁粉不再溶解,向溶液B中加入的铁粉质量至少应当大于________________;
(3)讨论当剩余固体的组成不同时m与n可能的取值范围,并填入下表
| 剩余固体的组成 |
m的取值范围 |
n的取值范围 |
| 只有铜 |
||
| 有铁且有铜 |
(用含m的代数式表示) |
市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 |
GB5461 |
| 产品等级 |
一级 |
| 配料 |
食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) |
20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于方框内)
□ KIO3 + □KI + □H2SO4 = □K2SO4 + □I2 + □H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
已知Na2SO3稀溶液与I2反应后溶液显酸性,写出该反应的离子方程式:。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是:________________________________;
②b中反应所产生的I2的物质的量是:mol;
A、B、C、D四种短周期元素的原子半径依次减小,在周期表中B与A、C 相邻,C的最外层电子数是其电子总数的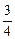 ,D能分别与A、B、C形成电子总数相等的化合物X、Y、Z。试回答:
,D能分别与A、B、C形成电子总数相等的化合物X、Y、Z。试回答:
(1)在X、Y、Z三种化合物中,沸点最高的是(用化学式表示,下同)_____________,稳定性由强到弱的顺序是___________________________________。
(2)若由A、B、C、D四种元素组成一种离子化合物,1 mol该化合物中含有10 mol原子,则该化合物受热分解的化学方程式为:___________ 。
若由A、B、 C、D四种元素中的两种组成化合物,化合物中分子的空间构型为直线型。写出符合上述要求且原子数不少于3的任意两种化合物的结构式:___________________________________。
C、D四种元素中的两种组成化合物,化合物中分子的空间构型为直线型。写出符合上述要求且原子数不少于3的任意两种化合物的结构式:___________________________________。
(3)Y跟HCl反应生成固体。该固体跟有毒的工业盐NaNO2的水溶液混合加热,NaNO2被完全破坏,当有1 mol NaNO2发生反应时,共有3 mol电子转移,该反应的化学方程式为_________________________。
2010年8月7日甘肃舟曲发生特大泥石流灾害,专家指出,为防止大灾过后瘟疫发生,可用含氯消毒剂和过氧化物对环境消毒。
(1)气体二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3溶液在H2SO4存在下与Na2SO3溶液反应制得。请写出该反应的离子方程式:
(2)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只作氧化剂的是 (填序号)。
| A.MnO2 | B.KMn O4溶液 O4溶液 |
C.稀盐酸 | D.Na2SO3溶液 |
(3)漂白剂亚氯酸钠(NaClO2)在常温下于黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子数是 。
(4)物质的标准生成热是指由稳定的单质生成1mol指定物质时的热效应。如H2O(l)的生成热为-285.8 kJ·mol-1,用热化学方程式表示为 H2(g)+1/2O2(g)=H2O(l);△H= -285.8 kJ·mol-1。查表知ClO2的标准生成热是+102.5kJ·mol-1,则该反应用热化学方程式表示为________________________________。