有A、B、C、D四种元素。其中A为第四周期元素,与D可行成1∶1和1∶2原子比的化合物。B为第四周期d区元素,最高化合价为7。C和B是同周期的元素,具有相同的最高化合价。D为所有元素中电负性第二大的元素 。
。
(1)试写出四种元素的元素符号:A____ B____ C____ D____
(2)按电负性由大到小排列:________________。
由短周期元素组成的中学常见物质A、B、C、D、E存在右图转化关系(部分生成物和反应条件略)。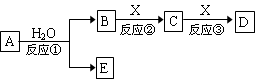
(1)若反应①在常温下进行,且E有漂白、杀菌作用,C是造成温室效应的主要气体,则:
E的电离方程式为,反应③的离子反应方程式为。
(2)若反应①是重要的工业反应之一, X是生产生活中使用最广泛的金属,则:
a.若B为气体单质,反应①的化学反应方程式为。
b.若E为非金属氧化物,C的化学式为。
(3)若A分子含有4个碳原子,D、E是同种有机物,75% B的水溶液常用于医疗消毒,则:反应①的化学反应方程式为。
(4)若A由两种元素构成,B为气体,E为白色沉淀,B、E都能使酚酞试液变红,则:反应①的化学反应方程式为。
Ⅰ.向FeCl3溶液中加入铁粉和铜粉混合粉末,充分反应后,下列情况可能存在的是(填序号)
| 序号 |
溶液中的盐 |
固体不溶物的成分 |
| ① |
FeCl3、CuCl2 |
Fe、Cu |
| ② |
FeCl2、CuCl2 |
Cu |
| ③ |
FeCl2 |
Cu |
| ④ |
FeCl3、CuCl2 |
Cu |
| ⑤ |
FeCl2、CuCl2 |
Fe |
| ⑥ |
FeCl2、CuCl2、FeCl3 |
没有固体不溶物 |
| ⑦ |
FeCl2 |
Fe、Cu |
Ⅱ.今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4mol/L的FeCl3,溶液(其他用品略),某课外活动小组同学的实验结果如下(假定反应前后溶液体积不变)。
| 组别 |
① |
② |
③ |
④ |
| 混合粉末质量/g |
40 |
40 |
40 |
40 |
| V[FeCl3(aq)]/mL |
150 |
300 |
330 |
350 |
| 反应后剩余固体质量/g |
23.2 |
6.4 |
2.56 |
x |
(1)试判断第④组剩余固体质量x为。第①组实验中,发生反应的离子方程式为。
(2)试判断第②组剩余固体的成分为。
(3)原混合粉末中Fe、Cu的物质的量之比为。
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl–、OH–、NO3–、CO32–、Xn-中的一种。
(1)某同学通过分析比较,认为无需检验就可判断其中必有的两种物质是
和(填化学式)。
(2)为了确定Xn–,现将(1)中的两种物质记为A和B,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生混合物沉淀,向该沉淀中滴入稀盐酸,沉淀部分溶解,最后仍有白色沉淀不再溶解。则:
①Xn-为(填序号)。
A.SO32– B.SO42–C.CH3COO– D.SiO32–
②写出物质C与B反应的离子反应式
③将0.2mol的A与0.1mol的C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的物质的量为mol。
④利用上述已经确定的物质(填化学式),可以检验出D、E中的阳离子。
(12分)(1)理论上将SO2通入BaCl2溶液中并不产生沉淀,再通入另一种气体后可以产生白色沉淀.例如通入NO2,写出由SO2生成沉淀的离子反应方程式_________________________。如果通入_________(填化学式)气体,则生成另一种白色沉淀___________(化学式)
(2)实际操作中将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程
则操作①的名称为________,试剂A的化学式为________。
实验表明,加入试剂A后,白色沉淀未见溶解,产生该白色沉淀的离子方程式是___________________________。
.工业生产纯碱的工艺流程示意图如下: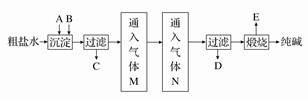
(1)粗盐水中加入沉淀剂A、B以除去杂质制取精盐(沉淀剂A来源于石灰窑厂),
写出B的化学式________________。
(2)向过滤出C后的滤液中通入气体NH3和CO2,则气体M是____________________(填化学式),选择的理由是______________。通入气体N后现象是___________
(3)滤液D最主要的成分是________(填写化学式),检验这一成分的阴离子的具体方法是__________________________。