室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按下面的框图进行反应。又知E溶液是无色的。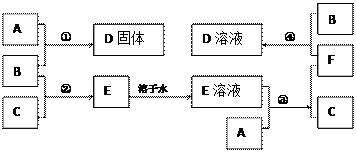
请回答:
(1)写出A、B、C的化学式。
A: B: C:
(2)反应①的化学方程式为:
(3)反应③的化学方程式为:
(4)反应④的离子方程式为:
用离子方程式表示下列化学变化:
(1)电解氯化钠溶液____________________________________________
(2)电解硝酸银溶液____________________________________________
在密闭容器中进行可逆反应,A与B反应生成C,其反应速率可分别用v(A)、v(B)、v(C)表示,且有如下关系:v(B)=3v(A),v(C)=2v(A),3v(C)=2v(B),则该反应的化学方程式为:.
 反应过程的能量变化如图所示。已知1
氧化为1
的
.请回答下列问题:
反应过程的能量变化如图所示。已知1
氧化为1
的
.请回答下列问题:
(1)图中
点表示。
的大小对该反应的反应热有无影响。该反应通常用
作催化剂,加
会使图中
点升高还是降低,理由是;
(2)图中
=
;
(3)
的催化循环机理可能为:
氧化
时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式
,。
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的简化电子排布式为________。
(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近。Cl2、BrI、ICl沸点由高到低的顺序为_________。
(3)多卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为。
(4)I3+(可看成II2+)属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为。
(5)气态氟化氢中存在二聚分子(HF)2,这是由于。
(6)①HClO4、②HIO4、③H5IO6 [可写成(HO)5IO] 的酸性由强到弱的顺序为(填序号)。
据报道:美国海军科学家拟提取海水中溶解的二氧化碳,利用类似FT合成的方法生产短链不饱和烃,以作为汽油的替代品。研究发现,如果使用铁作催化剂,二氧化碳与氢气反应产生30%的甲烷,其余的短链烃可以被用来提炼燃料。
(1)为延缓全球温室效应,二氧化碳捕获和封存技术(CCS)是当今化学的前沿技术,下列通过化学反应捕获二氧化碳的反应,其原子利用率达100%的是。
(a)CO2 +CaO  CaCO3(b)K2CO3+CO2+H2O=2KHCO3
CaCO3(b)K2CO3+CO2+H2O=2KHCO3
(c)2Mg+CO2 2MgO+C
2MgO+C
(d)
(2)用二氧化碳合成烃,需要提供辅助原料氢气,下列制取氢气的方法可行且二氧化碳零排放的是。
(a)用太阳能光解海水制氢(b)利用天然气与水高温催化制氢
(c)利用活泼金属与海水反应制氢(d)利用核反应堆多余的电能电解海水制氢
(3)所谓FT合成,就是CO在金属催化剂上催化氢化反应,生成以直链烷烃和烯烃为主的混合物的过程。CO2与H2合成汽油(平均组成设为C8H18)反应的化学方程式为:。
(4)某文献报道:在300℃、30MPa,以Fe、CoCl2作催化剂条件下,CO2和H2反应生成丁烷和戊烷。
①假定在一实验容器中充入一定量的CO2和H2,加入催化剂,若CO2和H2转化率均为100%,产物只有丁烷和戊烷, n(H2)/n(CO2)=a,a取值范围为:。
②据问题①,今有标准状况下的CO2448L, n(丁烷)/n(戊烷) =x,消耗H2的物质的量为y,则y=(用x表示)。