(1)X元素的原子核外有2个电子层,其中L层有5个电子,则该元素在周期表中的位置为 ,其气态氢化物的化学式为 ,最高价氧化物的化学式为 ,该元素的最高价氧化物对应水化物的化学式为 。
(2)R为1—18号元素中的一种非金属元素,若其最高价氧化物对应水化物的化学式为HnROm,则此时R元素的化合价为 ,R原子的最外层电子数为 ,其气态氢化物的化学式为 。
(16分)氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)室温下,0.1mol/L的亚硝酸(HNO2)、次氯酸的电离常数Ka分别为: 7.1×10-4, 2.98×10-8。将0.1mol/L的亚硝酸稀释100倍,c(H+)将(填“不变”、“增大”、“减小”);Ka值将(填“不变”、“增大”、“减小”)。写出HNO2、HClO、NaNO2、NaClO四种物质之间发生的复分解反应的离子方程式。
(2)羟胺(NH2OH) 可看成是氨分子内的l 个氢原子被羟基取代的产物,常用作还原剂,其水溶液显弱碱性。已知NH2OH 在水溶液中呈弱碱性的原理与NH3在水溶液中相似,请用电离方程式表示其原因。
(3)亚硝酸钠与氯化钠都是白色粉末,且都有咸味,但亚硝酸盐都有毒性,通常它们可以通过加入热的白醋鉴别,亚硝酸钠遇到白醋会产生一种红棕色刺激性气味气体和一种无色刺激性气味气体,该反应的离子方程式为。
(4)磷及部分重要化合物的相互转化如图所示。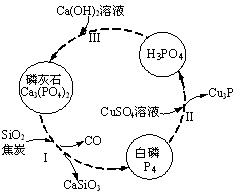
①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是。
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为。
(5)若处理后的废水中c(PO43-)=4×10-7 mol·L-1,溶液中c(Ca2+)=mol·L-1。(已知Ksp[Ca3(PO4)2]=2×10-29)
(6)某液氨-液氧燃料电池示意图如下,该燃料电池的工作效率为50%,现用作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液中NaOH的浓度为0.3 mol·L-1,则该过程中消耗氨气的质量为。(假设溶液电解前后体积不变)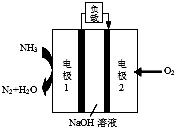
(14分)工业上可以利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2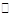 CH3OH+H2O。请回答下列问题:
CH3OH+H2O。请回答下列问题:
(1)已知常温常压下下列反应的能量变化如下图所示:
写出由二氧化碳和氢气制备甲醇的热化学方程式___。
(2)如果只改变一个条件使上述反应方程式的平衡常数K值变大,则该反应__(选填编号)。
| A.一定向正反应方向移动 |
| B.在平衡移动时正反应速率先增大后减小 |
| C.一定向逆反应方向移动 |
| D.在平衡移动时逆反应速率先减小后增大 |
(3)其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图所示。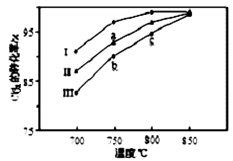
①在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是________。
②a点所代表的状态________(填“是”或“不是”)平衡状态。
③c点CO2的转化率高于b点,原因是________。
(4)若反应的容器容积为2.0L,反应时间4.0 min,容器内气体的密度减少了2.0g/L,在这段时间内CO2的平均反应速率为。反应在t1时达到平衡,过程中c(CO2)随时间t变化趋势曲线下图所示。保持其他条件不变,t1时将容器体积压缩到1L,请在图中画出t1后c(CO2)随时间t变化趋势曲线(假定t2时刻达到新的平衡)。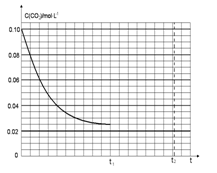
(15分)化学——选修3:物质结构与性质
Ⅰ.已知砷化镓的晶胞结构如图所示。请回答下列问题:
(1)下列说法正确的是__________(填序号)
| A.砷化镓晶胞结构与NaCl相同 | B.第一电离能 As>Ga |
| C.电负性 As>Ga | D.原子半径 As>Ga |
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为:__________________________
(3)AsH3空间形状为___________;已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为____________;
Ⅱ.金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(4)请解释金属铜能导电的原因 ,Cu2+的核外电子排布式为________________。
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3) 4]SO4晶体,晶体中含有的化学键除普通共价键外,还有和。
选考(15)化学与技术
侯氏制碱法的生产流程可表示如下,请回答下列问题: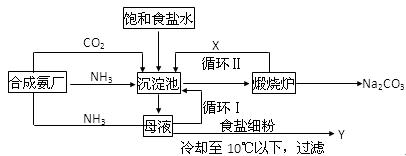
(1)沉淀池中加入(或通入)有关物质的顺序为_____________→___________→___________
(2)写出上述流程中X、Y的化学式:X____________Y___________
(3)写出沉淀池中发生的化学反应方程式__________________________________________
(4)侯氏制碱法的生产流程中可以循环使用的物质主要为____________、______________
(5)从沉淀池中取出沉淀的操作是___________,为了进一步提纯NaHCO3晶体,可采用_______法
(6)若在煅烧炉中燃烧的时间较短,NaHCO3将化解不完全。现若取10.5g NaHCO3固体,加热一定时间后,剩余固体的质量为7.1g,如果把此剩余固体全部加入到200mL 1mol/L的盐酸中,充分反应后溶液中H+的物质的量浓度为___________mol/L(溶液体积变化忽略不计)
CO是水煤气的主要成份之一,是一种无色剧毒气体,根据信息完成下列各题
Ⅰ、已知下列热化学方程式
2C(s) + O2(g) = 2CO(g) △H = -221kJ/mol
C(s) + O2(g) = CO2(g) △H = -393kJ/mol
24g单质碳在不足量的O2中燃烧时,生成等物质的量的CO和CO2气体,则和24g单质碳完全燃烧生成CO2相比较,损失热量_________kJ
Ⅱ、850℃时,在10L体积不变的容器中投入2molCO和3molH2O,发生如下反应:
CO(g) + H2O(g) CO2(g) + H2(g)
CO2(g) + H2(g)
当CO的转化率达60%时,反应达平衡
(1)850℃时,该反应的平衡常数为_________
(2)该条件下,将CO和H2O都改为投入2mol,达平衡时,H2的浓度为_________mol/L,下列情况能说明该反应一定达平衡的是_________
| A.CO和H2O蒸气的浓度之比不再随时间改变 |
| B.气体的密度不再随时间改变 |
| C.CO和CO2的浓度之比不再随时间改变 |
| D.气体的平均摩尔质量不再随时间改变 |
Ⅲ、为防止CO使人中毒,一种CO分析仪的工作原理如图所示,该装置中电解质为氧化钇——氧化钠,其中O2-可以在固体NASICON中自由移动,则:
(1)该原电池中通入CO的电极为_________极,该电极的电极反应式为___________________
(2)通空气一极的电极反应式为____________________________________