水是宝贵资源,研究生活和工业用水的处理有重要意义。请回答下列问题:
(1)已知水的电离平衡曲线如图所示。A、B、C三点水的电离平衡常数KA、KB、KC关系为 ,若从B点到D点,可采用的措施是 (填序号)。
(填序号)。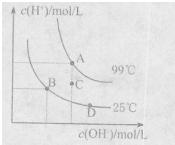
a。加入少量盐酸
b.加人少量碳酸钠
c.加人少量氢氧化钠
d.降低温度
(2)饮用水中的NO3-主要来自于NH4+。已知在微生物的作用下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下: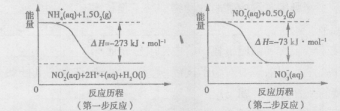
1 molNH4+全部被氧化成NO3-的热化学方程式为 。
(3)某工厂用电解法除去废水中含有的Cr2O72-,总反应方程式为:
Cr2O72-+6Fe+17H2O+2H+ 2Cr(OH)3↓+6Fe(OH)3↓+6H2↑,该电解反应的负极材料反应的电极式为 ,若有9 mol电子发生转移,则生成的cr(OH)3物质的量为 。
(4)废水中的N、P元素是造成水体富营养化的主要因素,农药厂排放的废水中。常含有较多的NH4+和PO43-,其中一种方法是:在废水中加人镁矿工业废水,可以生成高品位的磷矿石——鸟粪石,反应的离子方程式为Mg2++NH4++PO43- MgNH4PO4↓。该方法中需要控制污水的pH为7.5—10,若pH高于l0.7,鸟粪石产量会降;低,其原因可能是 。
现有A、B、C、D四种短周期元素,已知A、B同主族,B、C、D同周期,A、B的原子序数之和等于C、D的原子序数之和,C的单质能分别跟B和D的最高价氧化物的水化物反应。请回答:
(1)B和C的元素符号分别为_____________________
(2)上述四种元素的原子半径由大到小的顺序为__________________(用元素符号表示)
(3)D单质在A单质中燃烧的产物与二氧化碳反应的化学方程式为_____________________
(4)B单质能跟D的最高价氧化物水化物的浓溶液发生氧化还原反应,生成的两种盐的水溶液均呈碱性,该氧化还原反应的离子方程式为_____________________________
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活的事例中发生了氧化还原反应的是。
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。
试写出有水参加、水为还原剂且为类型Ⅳ的一个化学方程式:。
(3)NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2反应的离子方程式是: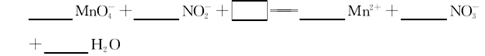
①请补充完整,配平方程式并标出电子转移的方向和数目。
②某同学称取了7.9 g KMnO4,固体,欲配制100 mL溶液。回答下列问题:
该实验中,使用容量瓶时要检查是否漏水,其操作是。
③不规范的实验操作会导致实验结果的误差。下列操作会使实验结果偏小的是(填序号)。
A.在溶解过程中有少量液体溅出烧杯外
B.定容时仰视容量瓶上的刻度线
C.定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
④某同学用上述配好的KMnO4溶液滴定未知浓度的NaNO2溶液:取20 mL未知浓度的NaNO2溶液于锥形瓶;取上述配好的KMnO4溶液于________(填“酸式”或“碱式”)滴定管,滴定完成后消耗KMnO4溶液10 mL,则NaNO2溶液的浓度为________________。
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料。工业合成氨的反应如下:N2(g) +3H2(g)  2NH3(g)△H=一92. 4 KJ·mol-1
2NH3(g)△H=一92. 4 KJ·mol-1
(1)2NH3(g)  N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有
N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有
①单位时间内生成3n mol H2:同时生成2n mol NH3②用NH3、N2、H2表示反应速率比为2∶1∶3 ③混合气体的密度不再改变 ④混合气体压强不再改变 ⑤混合气体平均相对分子质量不再改变
| A.①③④ | B.①②④⑤ | C.①④⑤ | D.②③④ |
(2)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2]。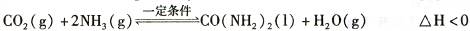
t℃时,向容积恒定为2L的密闭容器中加入0.10 molCO:和0. 40 molNH3 ,70 min开始达到平衡。反应中CO2 ( g)的物质的量随时间变化如下表所示:
| 时间/min |
0 |
30 |
70 |
80 |
100 |
| n(CO2) /mol |
0.10 |
0.060 |
0.040 |
0.040 |
0.040 |
①20 min时,υ正(CO2 )_ 80 min时。υ逆(H2O)(填“>”、“=”或“<”)。
②在100 min时,保持其它条件不变,再向容器中充入0. 050 mo1CO2和0. 20 molNH3,重新建立平衡后CO2的转化率与原平衡相比将_(填“增大”、“不变”或“减小”)。
③上述可逆反应的平衡常数为_(保留二位小数)。
④根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图像;保持其它条件不变;则(t+10)℃下正确的图像可能是(填图甲中的“A”或“B”)。
⑤图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气。该装置中阳极的电极反应式为,若两极共收集到气体22. 4L(标
况),则消耗的尿素为g(忽略气体的溶解)。
常温下有0. 1 mol/L的以下几种溶液,①H2SO4溶液②NaHSO4溶液③CH3COOH溶液④HCl溶液⑤HCN溶液⑥NH3·H2O,其中如下几种溶液的电离度(即已经电离的占原来总的百分数)如下表(已知H2SO4的第一步电离是完全的),回答下面问题:
| ①H2SO4溶液HSO4- |
②NaHSO4溶液HSO4- |
③CH3COOH |
④HCl溶液 |
| 10% |
29% |
1.33% |
100% |
(1)常温下,pH相同的表格中几种溶液,其物质的量浓度由大到小的顺序是(填序号,下同)_
(2)常温下,将足量的锌粉投人等体积pH=1的表格中几种溶液中,产生H2的体积(同温
同压下)由大到小的顺序是__
(3)在25℃时,若用已知浓度的NaOH滴定未知浓度的CH3 COOH应选用_作指示剂,若终点时溶液pH = a,则由水电离的。c(H+)为_。
(4)在25℃时,将b mol·L-1的KCN溶液与0. O1 mol·L-1的盐酸等体积混合,反应达到平衡时,测得溶液pH = 7,则KCN溶液的物质的量浓度b_0.01 mol·L-1填“>”、“<”或“=”);用含b的代数式表示HCN的电离常数Ka=
铁黄是一种重要的颜料,化学式为Fe2O3·xH2 O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含FeZ 0。及少量的CaO, Mg0等)和黄铁矿粉
(主要成分为FeS2)制备铁黄的流程如下: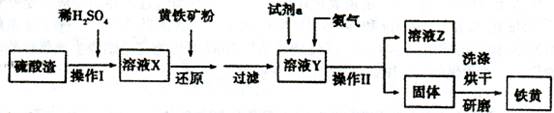
(1)操作I与操作II中都用到玻璃棒,玻璃棒在两种操作中的作用分别是_、
(2)试剂a最好选用_(供选择使用的有:铝粉、空气、浓HNO3 );其作用是_。
(3)上述步骤中需用到氨气。下列装置可用于实验室制氨气的是__(填序号)。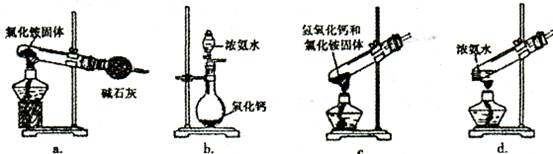
(4)查阅资料知,在不同温度下Fe2 O3被CO还原,产物可能为Fe3 O4、FeO或Fe,固体质量与反应温度的关系如右图所示。根据图象推断670℃时Fe2 O3还原产物的化学式为M,并设计一个简单的实验,证明该还原产物的成分(依次填写每步操作中所加试剂的化学式、现象和结论)。仪器自选。可供选择的试剂:稀H2SO4、稀盐酸、H2 O2溶液、NaOH溶液、KSCN溶液。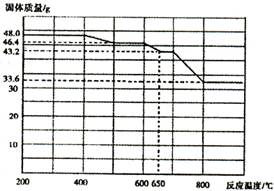
| 加入试剂 |
现象 |
结论 |
| 则还原产物为 |
||