丙酸的结构为CH3—CH2—COOH,丙酸盐是安全有效的防霉、防腐剂,一种以碱式碳酸锌为原料的生产工艺流程如下: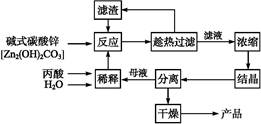
| 序号 |
n(丙酸)∶ n(碱式碳酸锌) |
反应温度/℃ |
丙酸锌产率/% |
| 1 |
1∶0.25 |
60 |
67.2 |
| 2 |
1∶0.25 |
80 |
83.5 |
| 3 |
1∶0.25 |
100 |
81.4 |
| 4 |
1∶0.31 |
60 |
89.2 |
| 5 |
1∶0.31 |
80 |
90.1 |
| 6 |
1∶0.31 |
100 |
88.8 |
(1)探究本实验中最佳工艺条件(见上表):反应时间2 h,用水量45 g,n(丙酸)∶n(碱式碳酸锌)=1∶ ,反应温度 ℃。
,反应温度 ℃。
(2)本工艺采用“闭路循环”方式,除具有制备工艺简便、产率高外,还具有 的优点。
(3)某次实验时,将37.0 g丙酸溶于220 mL水中,按上述流程在上述优化的条件下制备,最终得丙酸锌49.6 g,则该次实验丙酸锌的产率为 (写出计算过程)。
(8分)化合物A经李比希法测得其中含C 72.0%、H 6.67%,其余含有氧;质谱法分析得知A的相对分子质量为150。现代仪器分析有机化合物的分子结构有以下两种方法。
方法一:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1∶2∶2∶2∶3。
方法二:利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如下图: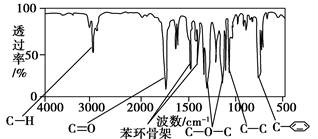
已知:A分子中只含有一个苯环,且苯环上只有一个取代基,试填空。
(1)A的分子式为__________;
(2)A的结构简式可能为__________;
(3)A的芳香类同分异构体有多种,其中分子中不含甲基的芳香酸为__________
钙,铝,铜都是中学化学常见的金属元素。
(1)Cu的基态原子的价电子排布图为
(2)基态Al原子中,电子占据的最高能层符号为,该能层具有的原子轨道数为,电子数为。
(3)Cu2O的熔点比Cu2S的高,其原因是
(4)CaC2是制备乙炔的原料,C22-与O22+互为等电子体,O22+的电子式可表示为,
1个O22+中含有个π键。
(5)AlCl3,NH3和AlCl4-中均含有配位键。在AlCl3﹒NH3中,提供空轨道的原子是,在AlCl3,NH3中Al原子采取杂化。
(8分,多选错选不得分)现有下列物质, 用编号填空回答下列问题:
A.干冰
B.金刚石
C.氦
D.过氧化钠
E.二氧化硅
F.氯化铵
(1)通过非极性键形成的原子晶体是:。
(2)可由原子直接构成的晶体是:。
(3)含有离子键、共价键、配位键的化合物是:。
(4)含有非极性键的离子化合物是:。
(5)已知微粒间的作用力包括离子键、共价键、金属键、范德华力、氢键 。氯化钠熔化,粒子间克服的作用力为____________;二氧化硅熔化,粒子间克服的作用力为____________;干冰气化,粒子间克服的作用力为____________。A、B、C、D四种物质的熔点从低到高的顺序为____________________(填序号)。
A、B、C、D、E五种元素,原子序数依次增大,A、B、C、D属于短周期元素。A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体G,D的L层电子数等于K、M两个电子层上的电子数之和。E、C同族且相邻。根据以上内容,回答下列问题
(1)A为,B为,D为。(填写相应的元素符号)。
(2)写出A、B的化合物与G反应的化学方程式并用双线桥表示出电子转移的方向和数目。
(3)比较B、C简单离子的半径大小:>。
(4)做E元素的焰色反应时,必须透过观察火焰的焰色,其颜色为色。
下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
⑩ |
(1)在这些元素中,化学性质最稳定的是(填元素符号)。最活泼的金属是(填元素符号),离子结构示意图为_________。元素⑩名称为,在周期表中的位置是。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______。
(3)这些元素中能形成两性氢氧化物的元素是(填名称),写出该元素的氢氧化物与④的最高价氧化物的水化物反应的离子方程式。
(4)元素①、②的最简单氢化物的稳定性:大于。(填写氢化物的分子式)
(5)请设计一个实验方案,比较⑥、⑦单质氧化性的强弱:。