氢气燃烧生成液态水的热化学方程式是:
2H2(g)+O2(g) ===2H2O(l) ΔH=-572kJ/mol
请回答下列问题:
(1)生成物能量总和 (填“大于” 、“小于”或“等于”)反应物能量总和。
、“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 (填“>”、“<”或“=”)572 kJ。
现有下列几种物质:①氨水 ②H2SO4③CaO ④CO2 ⑤红褐色的氢氧化铁胶体⑥Ba(OH)2⑦Al2(SO4)3 ⑧ 稀盐酸
(1)碱性氧化物与非含氧酸反应的化学方程式:________________
(2)⑦在水中的电离方程式为 .
(3)少量的④通入⑥的溶液中反应的离子方程式为 ,过量的④通入⑥的溶液中反应的离子方程式为 .
(4)实验室制备⑤操作 ,该反应的离子方程式: 。
(1)现有以下物质:①NaCl溶液 ②干冰 ③冰醋酸(纯净的醋酸)④铜 ⑤BaSO4固体
⑥蔗糖 ⑦酒精 ,其中属于电解质的是:
(2)标出横线上元素的化合价
①NH4 Cl② Na2O2③CaH2④H2C2O4⑤K2Cr2O7
(1)现有①铁片 ②熔融NaCl ③稀氨水 ④CH3COOH ⑤酒精 ⑥稀盐酸 ⑦H2SO4 ⑧KOH ⑨蔗糖 ⑩H2CO3,其中属于非电解质的是 ,属于强电解质的是 ,属于弱电解质的是 (用序号填空),选择其中的一种弱电解质,写出其在水中的电离方程式 。
(2)实验室制取Fe(OH)3胶体的化学反应方程式可表示为 。
(1)常温常压下,等质量的NO2和N2O4,二者的物质的量之比为________,原子个数之比为________,密度之比为_______。
(2) CO2气体在标准状况下的密度为_________g/L。
(3) 氢气是一种清洁的可再生能源。某氢氧燃料电池(氢气和氧气反应生成水)轿车,每行驶100 km仅耗氢气1 kg左右,同时消耗氧气的物质的量约为 。
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g)
M(g)+N(g)
所得实验数据如下表:
| 实验编号 |
温度/℃ |
起始时物质的量/mol |
平衡时物质的量/mol |
|
| n(X) |
n(Y) |
n(M) |
||
| ① |
700 |
0.40 |
0.10 |
0.090 |
| ② |
800 |
0.10 |
0.40 |
0.080 |
| ③ |
800 |
0.20 |
0.30 |
a |
| ④ |
900 |
0.10 |
0.15 |
b |
回答下列问题:
(1)实验①中,若5min时测得,n(M)=0.050mo1, 则0至5min时间内,用N表示的平均反应速率为_ 。
(2)实验③平衡常数为___________,该正反应为____________反应(填“吸热”或“放热”)
(3)能说明上述反应一定达到平衡的条件是_______________________。
A.c(Y)= c(N) B.平均分子量不再变化
C.v正(X) =v逆(M) D.温度和压强一定时,混合气体的密度不再变化
(4)实验③中,达到平衡时,X的转化率为_____________________。
(5)实验③、④中,达到平衡时,a与b的关系为__________(填选项),请解释原因________________。
A.a>2b B.a=2b C.b<a<2b D.a<b
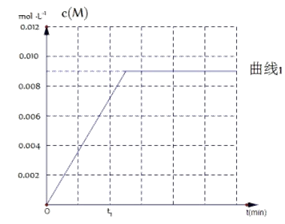
(6)图是实验①中c(M)随时间变化的曲线图,请在图中画出实验②中c(M)随时间变化的曲线图。