取m1g某常见粉末(由M、Z两种元素组成)进行如下实验。将该粉末和足量碳粉充分混合,平铺在反应管a中,b瓶中盛足量澄清石灰水。按图连接仪器并检查好气密性。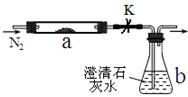
实验开始时,先进行操作G,过一段时间后,加热反应管a,观察到管内发生剧烈反应,并有熔融物生成。同时,b瓶的溶液中出现白色浑浊。经一系列测定,确定反应完全后,停止加热,继续通氮气,直到反应管冷却。此时,管中的熔融物凝固成银白色金属M,再进行分离、提纯、称量,得到m2g纯金属M,且m1=1.38m2。根据以上叙述回答问题:
(1)该粉末的化学式是_________ ____;操作G是______________________。
____;操作G是______________________。
(2)停止加热前是否需要先关闭止水夹K?_________;原因:_____________。
(3)反应管a中产生金属单质的化学方程式为:__________________________。 (4)本实验的尾气是否需处理?_______;如需处理,请回答如何处理;如不需处理,
(4)本实验的尾气是否需处理?_______;如需处理,请回答如何处理;如不需处理,
请说明理由。_______________________________________________。
(5)在题目“一系列测定”中,当连续_____________时,则可确定反应管中反应已完全。
(6)某同学做该实验时,b瓶最终得到了澄清溶液,他向该溶液中加入了某物质,溶液又出现了浑浊。请书写出现浑浊的离子方程式:___________________________。
某实验小组用下列装置进行乙醇催化氧化的实验。

 (1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式 、 。
、 。 (2)甲和乙两个水浴作用不相同。
(2)甲和乙两个水浴作用不相同。 甲的作用是 ;乙的作用是。
甲的作用是 ;乙的作用是。 (3)反应进行一段时间后,试管a中能收集到不同的物质,它们是。集气瓶中收集到的气体的主要成分是。
(3)反应进行一段时间后,试管a中能收集到不同的物质,它们是。集气瓶中收集到的气体的主要成分是。 (4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有。 要除去该物质,可在混合液中加入(填写字母)。
要除去该物质,可在混合液中加入(填写字母)。 a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过 (填试验操作名称)即可除去。
(16分,每空2分)用质量分 数为98%,密度为1.84 g•cm-3的浓硫酸配制100mL物质的量浓度为1mol/L的稀硫酸。
数为98%,密度为1.84 g•cm-3的浓硫酸配制100mL物质的量浓度为1mol/L的稀硫酸。
(1)需要使用的主要仪器有量筒、烧杯、玻璃棒、、。
(2)其操作步骤可分解为以下几步:
A.用量筒量取mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃 棒搅拌
棒搅拌
B.用约30mL蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液 都倒入容量瓶里
都倒入容量瓶里
C.将稀释后的硫酸小心地用玻璃棒引流容量瓶里
D.检查100mL容量瓶,是否漏水
E.将蒸馏水直接加入容量瓶,至液面接近刻度线
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切
请据此填写:
①完成上述步骤中的空白处。
②正确的操作顺序是(用字母填写):
()→()→()→()→()→()→()。
③进行A步操作时,选用量筒的规格是。(选填字母)
A.10mL B.50mL C.100mL D.1000mL
④如果对装有浓硫酸的量筒仰视读数,配制的稀硫酸浓度将(选填“偏高”、“偏低”、“无影响”)。
⑤A步骤操作完成时,必须后,才能进行后面的操作。
某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)请回答:
(1)各组反应开始时,______装置中的气球体积先变大,该装置中反应的离子方程式是。
(2)当试管中不再有气体生成时,三组实验出现不同现象。请参照第①组,分析原因的方式填写下表的空格
右图是铁粉和水蒸气反应的实验装置示意图
(1)写出该反应的化学方程式
(2)实验中,D处排出的气体几乎点不着,已知该装置不漏气,使用的各种药品没有质量问题,你认为气体点不着的可能原因是(说出一点即可):
(6分)粗盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。
(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程①放置酒精灯;②固定铁圈位置;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌;⑤停止加热。其正确的操作顺序为。
(2)该实验中加入除杂试剂的顺序不正确的是
| A.NaOH BaCl2 Na2CO3 | B.BaCl2 Na2CO3 NaOH |
| C.BaCl2NaOH Na2CO3 | D.Na2CO3NaOH BaCl2 |
(3)实验室检验SO42-所用的试剂为。
(4)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的作用和目的
溶解时:
过滤时:
蒸发时: