某溶液含有下表离子中的几种(不考虑水的电离及离子的水解)。溶液中阴离子物质的量为0.2mol,阳离子物质的量为0.3mol,阳离子只有两种。
| 阳离子 |
Ba2+ NH4+ Fe3+ Al3+ Fe2+ |
| 阴离子 |
OH- CO32- Cl- SO32- SO42- |
①若向原溶液中加入过量稀盐酸,无气体生成,得到溶液A。
②向溶液A中加入过量稀HNO3,再加AgNO3溶液,溶液中析出白色沉淀。过滤,得滤液B。
③往B中加入过量NaOH溶液并加热,有4.48L刺激性气味气体产生(不考虑气体溶解于水或与水反应,体积已折算为标准状况下的体积),同时有红褐色沉淀生成。过滤,得滤液C,此过程中沉淀的量不减少。
④若向原溶液中加入稀HNO3,再加足量BaCl2,有46.6g白色沉淀生成。
根据上述实验回 答下列问题。
答下列问题。
(1)写出步骤③中产生红褐色沉淀的离子方程式 。
(2)原溶液中一定不存在的阴离子是 。
(3)原溶液中的物质在空气中很容易被氧化,设计简单实验予以证明。简述操作步骤及可能观察到的实验现象 。
(4)若原溶液由一 种盐溶解于水制得,则该盐的化学式为 。
种盐溶解于水制得,则该盐的化学式为 。
(5)若原溶液由R和M(摩尔质量R>M)两种盐溶解于水制得,则这两种盐的
化学式为 、 ,其物质的量之比为 。实验室用工业废料制备盐R,在利用重结晶方法精制该盐时,需要趁热过滤,原因是 。
已知某有机物的结构简式如右图:它是具有环状结构的不饱和烃。现将该有机物与含有同物质的量溴的水溶液混合,发生加成反应。写出生成二溴代物的各种同分异构体的结构简式(请写出所有可能的结构): ______________。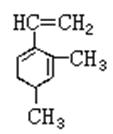
有机化合物分子中的邻近基团间存在着相互影响,苯环上原有的取代基对新导入苯环上的取代基的位置有一定的影响,其规律是
(1)苯环上新导入的取代基所占的位置主要决定于原有取代基的性质
(2)可以把原有取代基分成两类:第一类取代基主要使新导入的取代基进入苯环的邻位和对位,如-OH、-CH3、-X(卤素原子)等;第二类取代基主要使新导入的取代基进入苯环的间位,如-NO2、-SO3 H等。
H等。
请根据以上信息写出下列转化关系中A、B、C、D、E五种物质的结构简式。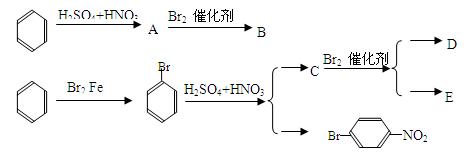
_A_________________________w _B_______________________
C_________ ________________D____
________________D____ _________________
_________________
m
_ _E_______________________
某有机化合物结构如下,分析其结构并完成下列问题: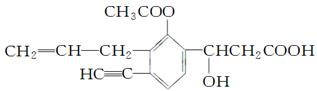
(1)写出其分子式__________。
(2)其中含有________个不饱和碳原子,分子中有________种双键
(3)一定与苯环处于同一平面的碳原子有________个,分子中C≡C—H键角为________。
实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。其装置如右图所示。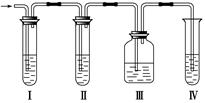
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是:
Ⅱ____________;Ⅲ__________;Ⅳ____________(将下列有关试剂的序号填入空格内)。
| A.品红溶液 | B.NaOH溶液 |
| C.浓H2SO4 | D.酸性KMnO4溶液 |
(2)能说明二氧化硫气体存在的现象是____________________________________________________________________
(3)使用装置Ⅱ的目的是_______________________________ ______________________________________
______________________________________
使用装置Ⅲ的目的是______________________________________________________________ _______
_______
(4)确证含有乙烯的现象是_____________________________________________________________________
立方烷是一种新合成的烃,其分子为正立方体结构,其碳架结构如图所示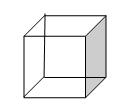
(1)写出立方烷的分子式________.
(2)其二氯代物共有_______种同分异构体。