某温度(t℃)时,水的Kw=10-13 mol2·L-2,则该温度(填大于、小于或等于) 25℃。将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,则:
(1)若所得混合液为中性,则a∶b ;
(2)若所得混合液的pH=2,则a∶b ;
 是周期表中原子序数依次增大的前20号元素。
是周期表中原子序数依次增大的前20号元素。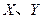 同周期。
同周期。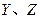 同主族,Zn-与
同主族,Zn-与 离子的电子层结构相同。由这四种元素形成的单质、化合物有如下图转化关系。已知:常温下
离子的电子层结构相同。由这四种元素形成的单质、化合物有如下图转化关系。已知:常温下 为液体,
为液体, 为气态化合物,且
为气态化合物,且 均为直线型分子;
均为直线型分子; 是由元素
是由元素 形成的常见化合物。
形成的常见化合物。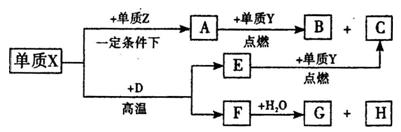
(1)元素 的名称,
的名称, 的电子式,F晶体中含有的化学键类型。
的电子式,F晶体中含有的化学键类型。
(2)写出 的化学式:
的化学式: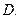 、
、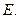 。
。
(3)①已知38g 与单质
与单质 完全反应生成
完全反应生成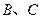 时放出
时放出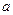 kJ的热量,写出该反应的热化学方程式:
kJ的热量,写出该反应的热化学方程式:
②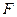 与水反应的化学方程式:
与水反应的化学方程式:
已知甲、乙、丙、丁、戊为纯净物,它们之间有如下转化关系。请填空:
(1)若甲为厨房中常见的调味品,在熔融条件下电解能实现上述转化。以惰性电极电解甲的水溶液时,电解反应的离子方程式为:。
(2)若甲为常见的离子化合物,可用作化肥,在加热条件下能实现上述转化。则反应②的化学反应方程式:。实验室测定丁的相对分子质量时,得到的实验值总是比理论值大,其原因是。(用方程式表示)
(3)若甲为制镜工业的常用物质,相对分子质量是甲醛的6倍,在催化剂存在条件下能实现上述转化。则反应①的化学反应方程式为:;以 乙物质为燃料的微生物燃料电池结构示意图如图所示,该原电[来池的负极反应方程式为
乙物质为燃料的微生物燃料电池结构示意图如图所示,该原电[来池的负极反应方程式为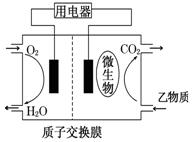
(6分)利用Cu + 2FeCl3 = CuCl2 + 2FeCl2反应,设计一个原电池。
(1)画出装置图(在图中标出电极材料、正负极、电解质溶液)。
(2)写出电极反应方程式
负极 :
:
正极:(各2分)
(5分)我国经济发展对能源的需求与日俱增。一种新型燃料电池是将两根特制电极插入氢氧化钾溶液中,然后从两极分别通入甲烷和氧气,其电极反应式为:
X极:CH4+10OH- -8e- ="=" CO32-+7H2O Y极:4H2O+2O2+8e- ==8OH-
( 1)、指出该电池的正极__________(X极或Y极)(1 分)
分)
(2)、在标准状况下,通入5.6L甲烷气体,完全反应后有__________mol电子转移;
(3)、该电池的电解质溶液的PH变化是__________(填升高、降低、不变)(2分)
已知拆开1mol H—H键, 1mol N三N键分别需要吸收的能量为436kJ , 946kJ;形成1mol N—H键,会放出能量391kJ,在反应N2 + 3H2 2NH3中,每生成2mol NH3 ____热量(填:吸收或放出)_____kJ(各2分)。
2NH3中,每生成2mol NH3 ____热量(填:吸收或放出)_____kJ(各2分)。