有机物A的结构简式为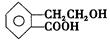 ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。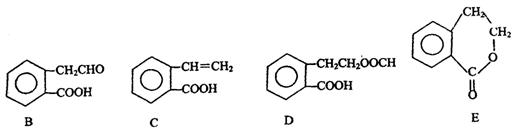
请回答下列问题:
(1)指出反应的类型:A→C: 。
(2)在A~E五种物质中,互为同分异构体的是 (填代号)。
(3)写出由A生成B的化学方程式
。
(4)C能形成高聚物,该高聚物的结构简式为 。
(5)写出D与足量NaOH溶液共热反应的化学方程式
。
铜是过渡金属元素,可以形成多种化合物。
(1)CuCl的盐酸溶液能够与CO发生反应:CuCl+CO+H2O=Cu(CO)Cl·H2O
①电负性:C ______O(填“>”或“=”或“<”)。
②CO常温下为气体,固态时属于晶体。
(2)Cu+与NH3形成的配合物可表示成[Cu(NH3)n]+,该配合物中,Cu+的4s轨道及4p通过sp杂化接受NH3提供的电子对。
[Cu(NH3)n]+中Cu+与n个氮原子的空间结构呈型,n=。
(3)CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):
请回答下列问题:
①配离子[Cu(En)2]2+的中心原子基态第L层电子排布式为。
②乙二胺分子中氮原子轨道的杂化类型为,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是:。
③配合物[Cu(En)2]Cl2中不存在的作用力类型有(填字母);
A配位键 B极性键 C离子键 D非极性键 E.氢键 F.金属键
(1)NaClO溶液在碱性条件下将CN-氧化成无毒的碳酸根离子和N2,该反应离子方程式。
(2)A、B、C、D四种元素,它们的原子序数依次增大,且均小于18,A和B在同一周期,A原子p能级有一个空轨道,B原子的p能级有两个未成对电子,0.1mol C单质能从酸中置换出 2.24L氢气(标准状态),此时它就变成与B离子电子层排布完全相同的离子。D离子的半径在B、C、D中为最小。则:
①A是_________,B是_________,C是_________,D是_______。(填名称)
②A单质和B单质充分反应生成的化合物的结构式是____________。
③B的一种同位素形成的单质,1mol这种单质中含中子的物质的量是20mol,则这种同位素原子质量数________。
(3)NH3·H2O的电离方程式为NH3·H2O NH4++OH-,试判断溶于水后,形成的合理结构是________。(填右图中的字母)
NH4++OH-,试判断溶于水后,形成的合理结构是________。(填右图中的字母) 
(4)把CoCl2溶于水后加氨水直到先生成的Co(OH)2沉淀又溶解后,再加氨水,使生成[Co(NH3)6]2+,此时向溶液中通入空气,得到的产物中有一种其组成可用CoCl3·5NH3表示,Co的配位数是6。把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1molCoCl3·5NH3只生成2molAgCl,CoCl3·5NH3中Co化合价为,请写出表示此配合物结构的化学式:。
(5)H2O、H2S、H2Se熔沸点由低到高的顺序:。
(6)HF比HCl热稳定(填“强”或“弱”),原因是: ____________。
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| a |
|||||||||||||||||
| b |
c |
d |
e |
f |
|||||||||||||
| g |
h |
i |
j |
k |
l |
m |
|||||||||||
| n |
o |
p |
|||||||||||||||
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子外围电子排布式:。
(2)c与a形成6个原子组成分子结构简式:,
该分子是:(填“极性”或“非极性”)分子。
(3)表中O、P两元素的部分电离能数据列于下表:
| 元素 |
O |
P |
|
| 电离能 kJ·mol-1 |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
比较两元素的I2、I3可知,气态O2+再失去一个电子比气态P2+再失去一个电子难。对此,你的解释是;
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
晶胞中i原子的配位数为,一个晶胞中i原子的数目为。
Ⅰ.如图所示是几种烷烃的球棍模型,试回答下列问题: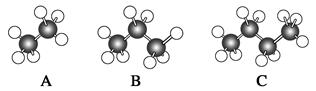
(1)A、B、C三者的关系是____________。
(2)A的分子式为__________,C的名称为__________。
(3)写出C的同分异构体的结构简式:________________________________。
Ⅱ.

以上各图均能表示甲烷的分子结构,__________种更能反映其真实的存在状况。
碳酸二甲酯(DMC)是一种近年来受到广泛关注的环保型绿色化工产品。在催化剂作用下,可由甲醇和CO2直接合成DMC:CO2+2CH3OH―→CO(OCH3)2+H2O,但甲醇转化率通常不会超过1%是制约该反应走向工业化的主要原因。某研究小组在其他条件不变的情况下,通过研究温度、反应时间、催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果。
计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量。
(1)已知25 ℃时,甲醇和DMC的标准燃烧热分别为ΔH1和ΔH2,则上述反应在25 ℃时的焓变ΔH3=________。
(2)根据反应温度对TON的影响图(图1)判断该反应的焓变ΔH____0(填“>”、“=”或“<”),理由是_________。
(3)根据反应时间对TON的影响图(图2),已知溶液总体积 10 mL,反应起始时甲醇0.25 mol,催化剂0.6×10-5 mol,计算该温度下,4~7 h内DMC的平均反应速率:________;计算10 h时,甲醇的转化率:________。
(4)根据该研究小组的实验及催化剂用量TON的影响图(图3),判断下列说法正确的是________。
a.由甲醇和CO2直接合成DMC,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义
b.在反应体系中添加合适的脱水剂,将提高该反应的TON
c.当催化剂用量低于1.2×10-5 mol时,随着催化剂用量的增加,甲醇的平衡转化率显著提高
d.当催化剂用量高于1.2×10-5 mol时,随着催化剂用量的增加,DMC的产率反而急剧下降