已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用。为 了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如下装置来进行实验。请回答相关问题。
了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如下装置来进行实验。请回答相关问题。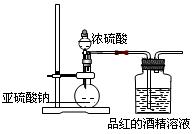
(1)为了探究干燥的SO2能不能使品红褪色,某同学设计了如图所示实验装置,请指出实验装置图设计中的不合理之处。
① ; ② .
(2)按照修改后的装置,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒
精溶液时,经过一小时后,品红仍不褪色。这说明品红褪色的原因不是二氧化硫直接导
致。为此,SO2能使品红的水溶液褪色的可能微粒有 。
(3)甲同学实验如下:取等量、相同浓度的品红水溶液于两支试管中,再分别加入少量
亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,对此,他得出结论:使品
红褪色的微粒是HSO3-和SO32-,不是H2SO3。你认为他的结论是否正确 ,其理由
是 。
(4)为了进一步探究,乙组同学做了如下实验:分别取相同浓度的品红水溶液各20ml于两只小烧杯中,两只烧杯中同时一次性各加入20ml 0.1mol/L的亚硫酸钠,20ml 0.1mol/L的亚硫酸氢钠溶液,发现加入亚硫酸钠溶液的品红褪色较快。
①微粒浓度与褪色快慢关系,请用“多”或“少”填写“ ”内容。
| 同浓度溶液 |
SO32- |
HSO3- |
H2SO 3 3 |
褪色速度 |
| Na2SO3溶液 |
多 |
少 |
少 |
快 |
| NaHSO3溶液 |
较上面 |
较上面 |
较上面 |
慢 |
②根据实验和分析,得出的结论是 。
氧化二氯是黄棕色具有强烈刺激性的气体。它的熔点-116℃,沸点3.8℃.氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1∶100)同时反应生成次氯酸溶液。制取少量氧化二氯,是用干燥的氧化汞与氯气反应(还生成HgO·HgCl2)。装置如图,仅铁架台和夹持仪器已略去。
部分物质的有关物理数据如下:
| 化学式 |
熔点(单位:℃) |
沸点(单位:℃) |
| N2 |
-209.86 |
-195.8 |
| O2 |
-218.4 |
-183 |
| CO2 |
-57 |
/ |
| NH3 |
-77.3 |
-33.35 |
| Cl2 |
-101 |
-34.6 |
试回答:
(1)A中深色固体与无色液体制备气体的离子方程式:。
(2)B中盛有液体c是饱和,C中的液体d是浓硫酸。
(3)氧化二氯制备出之后,要冷却为固态才便于操作和贮存,则E中的保温瓶中盛有致冷剂,它应是
(在干冰、冰水、液态空气、液氨中选择)。在E的内管得到的Cl2O中可能含有的主要杂质是反应物中过量的。
(4)装置D、E间的连接方式与A、B、C间的连接方式有明显的区别,这区别是D、E中无管、塞,用这些不同的连接方式的主要理由是氧化二氯接触有机物而。
电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,应考虑回收利用。按如下流程在实验室进行实验:从废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。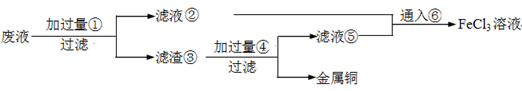
(1)写出FeCl3溶液与铜箔发生反应的化学方程式:。
(2)检验废腐蚀液中含有Fe3+的实验操作是
(3)“过滤”用到的玻璃仪器有:普通漏斗、。
(4)废液中加入过量①后,发生反应的离子方程式:
(5)上述流程中取废液200 mL,其中含CuCl2 1.5 mol·L—1、FeCl2 3.0 mol·L—1、FeCl3 1.0 mol·L—1,若要将铜全部回收,需加入Fe粉的质量应不少于_____________g;将铁的化合物全部转化为FeCl3溶液需通入Cl2的物质的量不少于_______________mol。
(6)某化学兴趣小组利用在下图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液。
制备Cl2的化学方程式为:
该装置不完整,请在所给虚线框内画出所缺部分,并标注试剂。
孔雀石主要含Cu2(OH)2CO3,还含少量Fe的氧化物和SiO2,实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下: 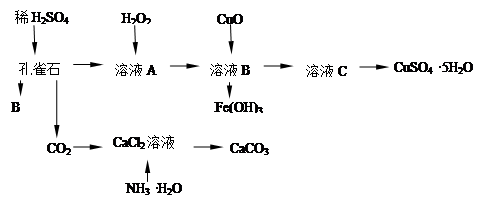
试回答下列问题:
(1)B物质的化学式是在未加入H2O2的溶液中,存在的金属离子有Cu2+、Fe2+、Fe3+。若检验该溶液中Fe3+,选择最合适的试剂是(填代号)。
| A.KMnO4溶液 | B.Fe粉 | C.Na2CO3溶液 | D.KSCN溶液 |
(2)向溶液A加入H2O2的作用是剂(填氧化或还原),离子反应方程式为,选用H2O2而不用Cl2的原因是。
(3)由溶液C获得CuSO4·5H2O,需要经过,过滤等操作。除烧杯、漏斗外,过滤操作还需用到另一玻璃仪器是。
(4)制备CaCO3时,先通入(填NH3或CO2),若实验过程中有氨气逸出,可选用下列装置中的(填代号)装置吸收氨气。(烧杯中的液体都为水)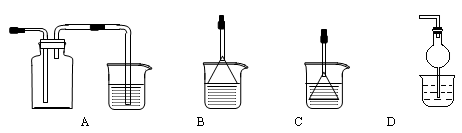
现有含CaO杂质的CaC2试样。某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度。请填写下列空白:
(1)第一种方案:请从下图中选用适当的装置,设计一个实验,测定CaC2试样的纯度。
所选用装置的连接顺序为(填各接口的字母):。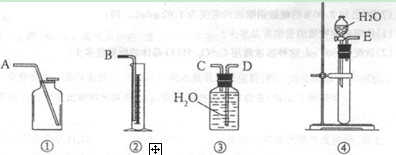
(2)第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数。先称取试样1.50g,并称量锥形瓶和水的质量为195.00g,再将试样加入锥形瓶中,反应过程中每隔相同时间测得的数据如下表。
| 读数次数 |
质量/g |
|
| 锥形瓶+水+试样 |
第1次 |
196.30 |
| 第2次 |
196.15 |
|
| 第3次 |
196.05 |
|
| 第4次 |
196.00 |
|
| 第5次 |
196.00 |
①计算CaC2的质量分数时,不必作第6次读数的原因是:。
②此试样中CaC2的质量分数为。(保留2位有效数字)
(3)第三种方案:称取一定质量的试样(1.60g),操作流程如下: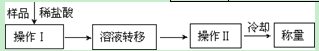
①操作Ⅱ的名称是。
②在转移溶液时,如溶液转移不完全,则CaC2质量分数的测定结果(填“偏大”、“偏小”或“不变”)。
人教版《必修1》关于Fe3+和Fe2+的转化的实验探究,某校教师为了检验学生完成每个实验过程时相应的问题解决思路,特设计一份化学探究学习“过程-思路”问卷。
(1)请在下表中右栏填写设计每一步操作过程的思路
| 过程 |
思路 |
| 1.提出假设:Fe2+具有还原性,可以被氧化成Fe3+;Fe3+具有氧化性,可以被还原成Fe2+ |
①根据氧化还原反应原理,一般物质有还原性,物质有氧化性 |
| 2.设计实验1:取少量FeCl2溶液,滴加几滴H2O2溶液,再向溶液中滴加几滴KSCN溶液,观察溶液是否变血红色 |
②用离子方程式表示选择H2O2的原因 ③用离子方程式表示溶液变血红色的原因 |
| 3.设计实验2:取少量FeCl3固体于一试管,用已煮沸的蒸馏水溶解,滴加几滴KSCN溶液后迅速加入少量铁粉,盖上试管塞,观察溶液的血红色是否褪去 |
④选择铁粉的原因是(用化学方程式表示) ⑤为什么要用煮沸的水 |
| 4.实施实验 |
…… |
| …… |
…… |
(2)教材中实验方案如下:取2mLFeCl3溶液,加入少量铁粉,充分反应后,滴入几滴KSCN溶液,观察并记录实验现象。把上层清液倒入另一试管中,再滴入几滴氯水,又发生了什么变化?学生通过实践证明,实验效果很差:没有预期的红色出现,而是很淡的浅红色,试分析实验中出现异常的可能原因并加以改进使实验现象更明显。
⑥可能的原因:
⑦改进措施: