由短周期元素组成的X、Y、Z、M是中学化学常见的四种物质,它们有如图所示的转化关系,请根据题意回答问题。
(1)若X、Y、Z含有同种常见金属元素,M是O2。X为___________;Z与氢气在一定条件下化合生成一种产物,写出该反应的化学方程式________。
(2)若X、Y、Z含有同种常见非金属元素,气体Z能使品红溶液褪色。
①X的电子式为__________________ _______;
_______;
②Z与过量的氢氧化钠溶液反应的离子方程式是:_____________________________。
(3)若X的水溶液显碱性,X、M 均为气体,上述转化过程均在水溶液中进行。任写一个满足上述转化过程Y→Z反应的化学方程式______________________。
均为气体,上述转化过程均在水溶液中进行。任写一个满足上述转化过程Y→Z反应的化学方程式______________________。
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
(1)表中字母a元素在周期表中位置。
(2)写出b元素的最高价氧化物对应的水化物所含化学键类型。
(3)表内短周期元素形成的物质W、X、Y、Z,存在下列转化关系
其中X为表中字母c元素的最高价含氧酸浓溶液;Y能使品红溶液褪色;W为表中字母a元素形成的常见气体。
①反应I的化学方程式为;反应I的溶液中有一种白色固体析出,为了证明该物质常采用的实验方法为。
②反应Ⅱ的化学方程式为;写出一种提高Y转化率的方法。
③常温下d遇浓硫酸形成致密氧化物薄膜,若薄膜为Fe3O4,写出该反应的化学方程式。
(12分)下列有机化合物转化关系如图所示: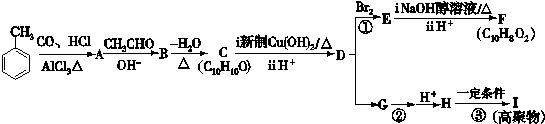
已知:
(1)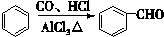
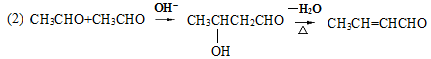
其中化合物A苯环上的一氯代物只有两种。
请回答下列问题:
(1)写出A的结构简式。
(2)B中含有的官能团的名称。
(3)①的反应类型为;化合物F的核磁共振氢谱显示有个峰。
(4)写出C与新制Cu(OH)2反应的化学方程式。
(5)已知两分子H能形成六元环酯,写出反应②的条件;反应③的化学方程式。
(6)化合物C有多种同分异构体,请写出其中满足下列条件的所有同分异构体的结构简式。
①遇氯化铁溶液显紫色;
②苯环上有三个取代基;
③苯环上的一氯取代物只有两种。
聚乙烯醇Z是具有广泛用途的合成高分子材料,结构简式为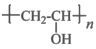 ,其工业合成路线如下:
,其工业合成路线如下: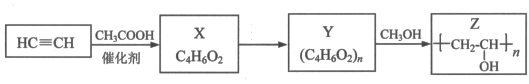
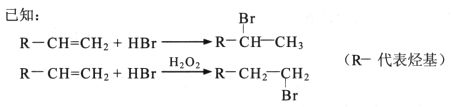
已知:下列反应中R,R',R"代表烃基
i.
ii.
回答下列问题:
(1)X的结构简式是________________________;
(2)Y转化为Z的化学方程式是________________________;
(3)已知:
在横线上填入物质、在方框内填上系数完成聚乙烯醇转化为维纶的化学方程式。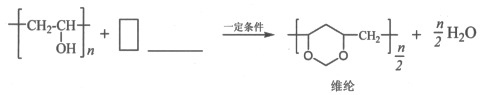
某物质E可做香料,其结构简式为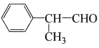 ,以苯为原料工业合成路线如下:
,以苯为原料工业合成路线如下:
回答下列问题:
(1)E的官能团是(写名称),②的反应类型是
(2)B的结构简式可能是____________、____________;
(3)步骤④的化学方程式是________________________;
(4)E有多种同分异构体,写出符合以下条件的结构简式___________(只写顺式结构)。
①具有顺反结构
②能与NaOH溶液反应
③分子中苯环上的一溴代物有两种
某同学设计了由乙醇合成乙二醇的路线如下。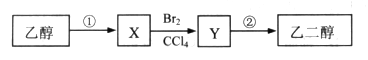
(1)X是(填名称)。
(2)X→Y的反应类型是。
(3)写出Y→乙二醇的化学方程式。
(4)等物质的量的乙醇、乙二醇完全燃烧,消耗氧气的物质的量之比是。