江苏省东海县矿产丰富,除了水晶制品名扬天下外,蛭石、蛇纹石等矿石储量大,品位高,其相关的耐火、保温隔热材料(主要成分为MgO、Al2O3)工业也较发达。某中学化学探究小组通过查阅相关资料,对蛭石的组成进行了实验探究。
Ⅰ.相关资料:①蛭石的成分可看成是由MgO、Fe2O3、Al2O3、SiO2组成;
②氢氧化物开始沉淀及沉淀完全时的pH:
| 氢氧化物 |
Fe(OH)3 |
Mg(OH)2 |
Al(OH)3 |
| 沉淀的pH范围 |
1.5~4.1 |
9.4~12.4 |
3.3~5.2 |
Ⅱ.相关实验: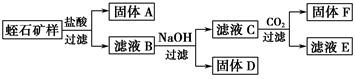
Ⅲ.实验数据:
①矿石样品质量为:8.22 g
②实验过程中得到固体的质量:A—2.40 g、D—2.14 g、F—1.56 g
③每次转化所得固体成分只有一种
请你根据以上内容和中学化学知识回答以下问题:
(1)过滤操作需要的玻璃仪器有:_____________________________________。
(2)写出由D制一种红色颜料的化学方程式:_____________________________________。
(3)工业上的耐火材料通常由F及滤液E进一步转化而成,请你根据滤液E中可能含有的成分,设计一个从滤液E制取耐火材料的实验方法:__________________________。
(4)滤液B与NaOH溶液反应时,应控制溶液的pH在7~8之间,这是因为_______________________________________________________。
(5)通过计算,写出用氧化物的形式表示蛭石组成的化学式:___________________________。
(8分)化合物A含硫(每个分子只含一个硫原子)、氧以及一种或几种卤素。少量A与水反应完全水解但不发生氧化或还原反应,所有反应产物均可溶于水。将A配成水溶液稀释后分成几份,分别加入一系列0.1mol/L的试剂,现象如下:
①加入硝酸酸化的硝酸银,产生白色沉淀;
②加入氯化钡溶液,无沉淀产生;
③溶液经酸化后加入高锰酸钾溶液,紫色褪去,再加入硝酸钡溶液,产生白色沉淀。
⑴由①判断组成该化合物的元素中,肯定存在的卤素有,由②判断A与水反应后生成的溶液中肯定不存在的离子有 。由③判断A与水反应后生成的溶液中肯定存在的离子有 .
。由③判断A与水反应后生成的溶液中肯定存在的离子有 .
⑵要确定该化合物的分子式,称取11.90gA溶于水稀释至250.00mL,取25.00mL溶液加入足量的高锰酸钾和硝酸钡溶液,使沉淀完全,沉淀经洗涤、干燥后称重为2.33g。试确定A的化学式,写出计算推理过程。
氯碱工业是高耗能产业,为了提高原料的利用率,将电解的Y气体作为燃料电池燃料,为电解池供电;X气体作为钛的冶炼原料,在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中氯碱工业装置中的电极未标出,所用的离子交换膜只允许阳离于通过。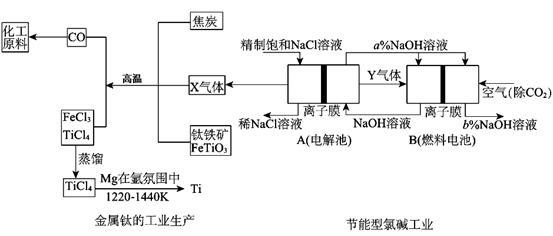
(1)①上图中的节能型氯碱工业部分,X、Y分别是、(填化学式),分析比较图示中NaOH质量分数a%与b%的大小;
②写出燃料电池B中正极上发生的电极反应:;
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式;
(3) TiCl4暴露在潮湿空气中冒白烟,白烟主要为白色的二氧化钛的水合物H2TiO3,写出该反应的化学方程式;
(4)已知:①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ·mol-1。
②1/2Ti(s)+ Cl2(g) =1/2TiCl4(1) △H=-385 kJ·mol-1。
则2Mg(s)+TiCl4(1)=2MgCl2(s)+Ti(s)的反应热为
(10分)A~G各物质间的关系如下图,其中B、D为气态单质。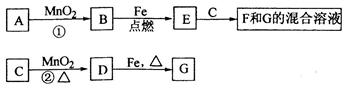
请回答下列问题:
(1)物质C和E的名称分别为________________、__________________;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为_____________;
若只能在加热情况下进行,则反应物A应为_____________;
(3)反应②的化学方程式为_______________________________________;
(4)新配制的F溶液应加入_____________以防止其转化为G。检验G溶液中阳离子的常用试剂是_____________, 实验现象为_____________________________________________。
实验现象为_____________________________________________。
(8分)胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8•nH2O)等化合物。
(1)三硅酸镁的氧化物形式为,某元素与镁元素不同周期但在相邻一族,且性质和镁元素十分相似,该元素原子核外电子排布式为。
(2)铝元素的原子核外共有种不同运动状态的电子、种不同能级的电子。
(3)某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径 (填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:
(填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:
(4) Al2O3、MgO和SiO2都可以制耐火材料,其原因是。
a.Al2O3、MgO和SiO2都不溶于水
b.Al2O3、MgO和SiO2都是白色固体 c.Al2O3、MgO和SiO2都是氧化物
c.Al2O3、MgO和SiO2都是氧化物
d.Al2O3、MgO和SiO2都有很高的熔点
.下图是周期表中短周期的一部分,A.B.C三种元素的原子核外电子数之和等于B的质子数的2倍。
1、(用元素符号表示)ABC
2、B的最高价氧化物的化学式,属于晶体。
3、C的气态氢化物的化学式,其中存在键。