第三代混合动力车,可以用电动机、内燃机或二者结合作为动力。汽车在刹车或下坡时,
电池处于充电状态。混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。下图是镍氢电池充放电原理的示意,其总反应式为: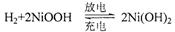 ,下列说法中正确的是
,下列说法中正确的是
| A.混合动力车上坡或加速时,溶液中的OH-向乙电极移动 |
| B.混合动力车刹车或下坡时,乙电极周围溶液的pH增大 |
| C.混合动力车上坡或加速时,乙电极电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH- |
| D.混合动力车刹车或下坡时,甲电极电极反应式为H2+2OH-+2e- =2H2O |
某芳香族化合物A,核磁共振氢谱显示有六组峰,苯环上的一氯代物有两种,分子结构中不含有甲基,一定条件下可以发生如下图所示的转化关系。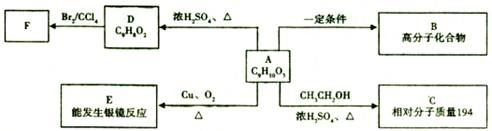
(1)E中含有的官能团名称为__________。
(2)D的结构简式为_________。
(3)C的分子式为_________,在一定条件下,可能发生的化学反应类型有_________。(填序号)
①水解反应 ②取代反应③消去反应④加成反应⑤加聚反应
(4)A→E反应的化学方程式为____________。
A→B反应的化学方程式为____________。
(5)F在加热条件下与过量NaOH水溶液反应的化学方程式为___________。
(6)符合下列条件的A的同分异构体有________种,其中苯环上一氯代物有两种的结构简式为________。
①含有二取代苯环结构
②与A有相同的官能团
③能与FeC13溶液发生显色反应
(1)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”(侯氏制碱法)两种工艺。
①“氨碱法”产生大量CaCl2废弃物,写出该工艺中产生CaCl2的化学方程式;
②写出“联合制碱法”有关反应的化学方程式________________。
③CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同______________________________________;
(2)钢铁工业对促进经济和社会发展起了重要作用。
① 炼钢时,加入硅、锰和铝的目的是_______________________。
② 不锈钢含有的Cr元素是在炼钢过程的氧吹____(填“前”或“后”)加入。
③ 炼铁和炼钢生产中,尾气均含有的主要污染物是________。从环保和经济角度考虑,上述尾气经处理可用作_________。
氧元素与多种元素具有亲和力,所形成化合物的种类仅次于碳元素。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为,氧元素与氟元素能形成OF2分子,该分子的空间构型为。
(2)根据等电子原理,判断NO2+离子中,氮原子轨道的杂化类型为,1molO22+所含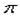 键的数目为。
键的数目为。
(3)氧元素与过渡元素可以形成多种价态的金属氧化物。如铬可生成Cr2O3、CrO3等,试写出Cr3+核外电子排式。
(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示: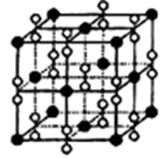
由此可判断该钙的氧化物的化学式为。已知晶胞边长为540pm,则该氧化物的密度是g·cm-3。
A、B、C、D、E、F、G都是链状有机物,它们的转化关系如图所示。A只含一种官能团,D的相对分子质量与E相差42,D的核磁共振氢谱图上有3个峰,且峰面积之比为1:3:6,请回答下列问题:
已知:Mr(R-Cl)-Mr(ROH)=18.5, Mr(RCH2OH)-Mr(RCHO)=2,
Mr表示相对分子质量。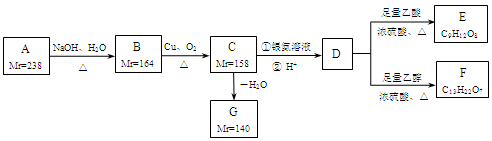
(1)A中含有的官能团是______。
(2)写出D的分子式______。
(3)下列有关A~G的说法正确的是______。
a.每个A分子中含有官能团的数目为4个
b.B中所有官能团均发生反应生成C
c.C生成G只有1种产物
d.G存在顺反异构现象
(4)写出B生成C的化学方程式______。
(5)芳香族化合物H与G互为同分异构体,1mol H与足量氢氧化钠溶液反应消耗2mol NaOH,且H苯环上的一氯代物只有两种,写出其中任意一个符合条件的H的结构简式______。
(6)E与足量NaOH溶液共热,此反应的化学方程式为______。
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):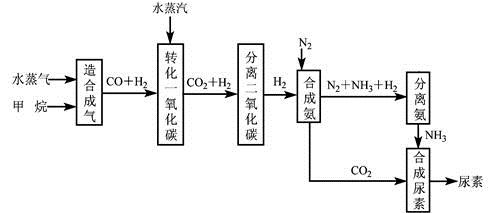
填写下列空白:
(1)已知0.5 mol甲烷和0.5 mol水蒸气在t ℃,p k Pa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量,该反应的热化学方程式是。
(2)上述流程中,工业上分离H2 、CO2合理的方法是。
A混合气先通入氢氧化钠溶液,再在溶液中加盐酸
B混合气加压冷却,使CO2液化
C混合气用氨水洗涤
D混合气先通入到石灰浆,然后高温煅烧固体,
(3)为了保证氨气顺利合成,在空气进入合成塔之前必须对空气进行,目的是____________________;在合成氨的实际生产过程中,常采取将生成的氨从混合气体中分离出来,分离出氨的方法。
(4)合理地利用资源不仅可以提高经济效益,而且也是对社会、对全人类负责的表现,阐述图中的两处可以合理利用资源情况。