火力发电厂释放出大量的氮氧化物(NOx).二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝.脱碳和脱硫等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g);ΔH1=-574kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g);ΔH2=-1160kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为: 。
2)脱碳。将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g);ΔH3
CH3OH(g)+H2O(g);ΔH3
① 取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3,分别加入温度不同、容积相同的恒容密闭容器中,发生上述 反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图所示,根据图示 (填写具体的线段)走向,则上述CO2转化为甲醇的反应的ΔH3 0(填“>”.“<”或“=”)。
反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图所示,根据图示 (填写具体的线段)走向,则上述CO2转化为甲醇的反应的ΔH3 0(填“>”.“<”或“=”)。
② 在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。下列说法正确的是 (填字母代号)。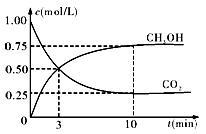
A.第10min后,向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时c(CH3OH) > 1.5 mol·L-1且化学平衡常数K值增大。 mol·L-1且化学平衡常数K值增大。 |
| B.0~10min内,氢气的平均反应速率为0.075mol•(L·min)-1 |
| C.达到平衡时,氢气的转化率为75 % |
| D.第10min后,升高温度将使n(CH3OH)/n(CO2)减小 |
(3)脱硫。燃煤废气经脱碳处理后,用空气氧化,并用氨气吸收生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程式为: 。
(4)硫酸铵和硝酸铵的水溶液的pH<7,其原因可用一个离子方程式表示为: ;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中存在着离子浓度关系为:c(Na+)+c(H+) c(NO)+c(OH-)(填写“>”“=”或“<”)。
(15分)化合物AX3和单质X2在一定条件下反应可生成化合物AX5,该反应不能彻底。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5时,放出热量123.8 kJ。该反应的热化学方程式为。
(2)一定条件下,反应AX3(g)+X2(g) AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行a、b、c三组实验,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行a、b、c三组实验,反应体系总压强随时间的变化如图所示。
①用P0表示开始时总压强,P表示平衡时总压强,用α表示AX3的平衡转化率,则α的表达式为。由此计算实验c中 AX3的平衡转化率:αc为。若在实验a中再加入0.1mol AX5,再次达平衡后AX3的平衡转化率将。(填“增大、减小或不变”)
②下列不能说明反应达到平衡状态的是。
| A.混合气体的平均相对分子质量保持不变 |
| B.混合气体密度保持不变 |
| C.体系中X2的体积分数保持不变 |
| D.每消耗1 mol AX3的同时消耗1 mol AX5 |
③计算实验a从反应开始至到达平衡v(AX5)化学反应速率为mol/(L·min)。(保留2位有效数字)
④图中3组实验从反应开始至到达平衡时的化学反应速率v(AX5)由大到小的次序为(填实验序号);与实验a相比,其他两组改变的实验条件是:b 、c 。该反应在实验a和实验c中的化学平衡常数的大小关系是KaKc(填“>、< 或 =”),其中Kc=(注意标明单位,且保留小数点后1位)。
(12分)在右图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,立即停止电解,取出A电极,洗涤、干燥、称量,电极质量增重1.6g。请回答下列问题: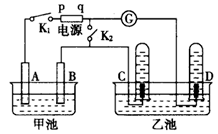
(1)电解过程中,乙池C电极发生反应的电极反应式。
(2)甲池电解时反应的离子方程式。
(3)甲池电解后溶液的pH=,要使电解后溶液恢复到电解前的状态,则需加入,
其质量为g。(假设电解前后溶液的体积不变)
(4)电解后若再将K1断开,闭合K2,电流计指针发生偏转,则D电极发生反应的电极反应式。
【化学——选修3:物质结构基础】有机反应中常用镍作催化剂。某镍催化剂中含Ni 64.0%、Al 24.3%、Fe 1.4%,其余为C、H、O、N等元素。
(1)氰酸(HOCN)的结构式是,其中碳原子的杂化方式是,根据等电子体原理,可推测氰酸根离子的空间构型是。
(2)用Cr2O3作原料,铝粉作还原剂的铝热法是生产金属铬的主要方法之一,该反应是一个自发放热反应,由此可判断Cr-O键和Al-O键中________________键更强。研究发现气态氯化铝(Al2Cl6)是具有配位键的化合物,可溶于非极性溶剂,分子中原子间成键的关系如下图所示。由此可知该分子是(填“极性”或“非极性”)的。请在图中是配位键的斜线上加上箭头。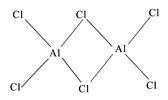
(3)铁有α、γ、δ三种晶体构型,其中α-Fe单质为体心立方晶体,δ-Fe单质为简单立方晶体。则这两种晶体结构中铁原子的配位数之比是,设α-Fe晶胞边长为a nm,δ-Fe晶胞边长为bnm,则这两种晶体的密度比为。(用a、b的代数式表示)
(4)氧化镍(NiO )是一种纳米材料,比表面积S(m2/g)是评价纳米材料的重要参数之一(纳米粒子按球形计)。 基态Ni2+有 个未成对电子,已知氧化镍的密度为ρg/cm3;其纳米粒子的直径为Dnm列式表示其比表面积 m2/g。
【化学——选修2:化学与技术】将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺流程提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是________(填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁等的提取工艺
(2)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收。已知该反应不产生CO2,且溴歧化为Br-和BrO3-,则反应的离子反应方程式为。
(3)海水提镁的一段工艺流程如下图: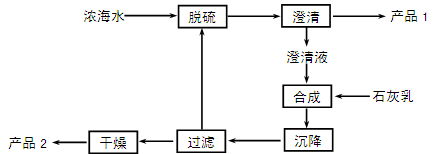
浓海水的主要成分如下:
| 离子 |
Na+ |
Mg2+ |
Cl- |
SO42- |
| 浓度/(g·L-1) |
63.7 |
28.8 |
144.6 |
46.4 |
该工艺过程中,脱硫阶段主要反应的阳离子________,沉降阶段反应的离子方程式为,浓海水的利用率为90%,则1L浓海水最多可得到产品2的质量为________g。
(4)由MgCl2·6H2O制备MgCl2固体时是在氯化氢气体氛围中加热进行,其目的是。
(16分)氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)室温下,0.1mol/L的亚硝酸(HNO2)、次氯酸的电离常数Ka分别为: 7.1×10-4, 2.98×10-8。将0.1mol/L的亚硝酸稀释100倍,c(H+)将(填“不变”、“增大”、“减小”);Ka值将(填“不变”、“增大”、“减小”)。写出HNO2、HClO、NaNO2、NaClO四种物质之间发生的复分解反应的离子方程式。
(2)羟胺(NH2OH) 可看成是氨分子内的l 个氢原子被羟基取代的产物,常用作还原剂,其水溶液显弱碱性。已知NH2OH 在水溶液中呈弱碱性的原理与NH3在水溶液中相似,请用电离方程式表示其原因。
(3)亚硝酸钠与氯化钠都是白色粉末,且都有咸味,但亚硝酸盐都有毒性,通常它们可以通过加入热的白醋鉴别,亚硝酸钠遇到白醋会产生一种红棕色刺激性气味气体和一种无色刺激性气味气体,该反应的离子方程式为。
(4)磷及部分重要化合物的相互转化如图所示。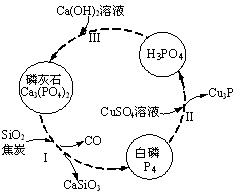
①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是。
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为。
(5)若处理后的废水中c(PO43-)=4×10-7 mol·L-1,溶液中c(Ca2+)=mol·L-1。(已知Ksp[Ca3(PO4)2]=2×10-29)
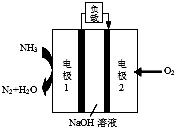
(6)某液氨-液氧燃料电池示意图如下,该燃料电池的工作效率为50%,现用作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液中NaOH的浓度为0.3 mol·L-1,则该过程中消耗氨气的质量为。(假设溶液电解前后体积不变)