(16分)化合物X是一种常用的香精。已知X的相对分子质量为100,X能水解,完全燃烧只生成CO2和H2O,且X分子中碳和氢元素总的质量百分含量约为68%。
(1)X的分子式是 。
(2)G和X互为同分异构体,且具有相同的官能团,用烃A合成G的路线如下: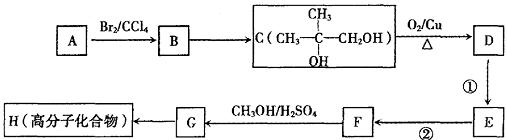
①写出A和D的结构简式:A. ,D. 。
②B→C反应的反应条件是 。
③E→F的反应类型是 反应,该反应的化学方程式为 。
④G→H的化学方程式为 。
(3)与D具有相同官能团的D的同分异构体还有的同 分异构体还有 种。
分异构体还有 种。
(1)反应Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常数为K1;
FeO(s)+CO(g) △H1,平衡常数为K1;
反应Fe(s)+H2O(g) FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
| 700℃ |
900℃ |
|
| K1 |
1.47 |
2.15 |
| K2 |
2.38 |
1.67 |
①反应CO2(g) + H2(g) CO(g) + H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g)
CO(g) + H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g) CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
②能判断CO2(g) + H2(g) CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O) D.c(CO)= c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。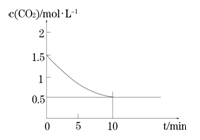
① 该条件下反应的平衡常数为 ;若铁粉足量,CO2的起始浓度为2.0mol·L-1,则平衡时CO2的浓度为____________mol·L-1。
②下列措施中能使平衡时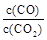 增大的是__________(填序号)。
增大的是__________(填序号)。
A.升高温度B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
依据氧化还原反应:2Ag+(aq) + Cu(s) ="=" Cu2+(aq) + 2Ag(s)设计的原电池如图所示。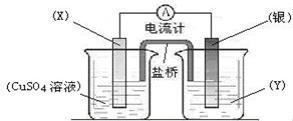
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极。
HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,请写出反应的离子方程式:_____________ 。
(4) Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2∶1,试配平下列方程式: FeSO4+ K2O2 → K2FeO4+ K2O+ K2SO4+ O2↑,当转移了1.5NA个电子时,在标况下可收集到 升氧气。
(6)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,高铁酸钾作为水处理剂发挥的作用是______________________ 。
NH3在工业生产上有重要的应用
(1)写出用浓氨水检验氯气管道泄漏的化学反应方程式
(2)若将少量氨气与过量氯气混合,则生成一种酸和另一种化合物A,A中所有原子均满足8电子稳定结构,试写出A的电子式 ;A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式 .
锰的化合物种类较多,也大多具有广泛的用途。
I.MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性。某化学兴趣小组通过实验探究MnO2的性质。
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是_____________。
A.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
B.把MnO2固体加入到H2O2溶液中,观察是否有气泡产生
C.Na2 SO3溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
D.FeSO4溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
(2)为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在
室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL 0.2mol/L NaOH溶液、1mL水、1mL 0.1mol/L硫酸。现象记录如下:
| 试管编号 |
实验现象 |
| A |
溶液不变色 |
| B |
溶液缓慢变浅棕褐色 |
| C |
溶液迅速变棕褐色 |
从以上实验中,我们可以得出的结论是____________。
②写出C试管中发生反应的离子方程式:________________。
Ⅱ,铁酸锰( MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机。MnFe2O4的制备工艺流程如下图:
已知Fe3+、Mn2+沉淀的pH如表所示。
| 开始沉淀 |
完全沉淀 |
|
| Fe3+ |
2.7 |
4.2 |
| Mn2+ |
8.3 |
10.4 |
①步骤一中投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比理论上应为___________________。
②步骤二中需控制pH的范围是_______________
③步骤三中是否洗涤干净的判断方法是_____________.