某有机化合物A能发 生如下图所示转化:
生如下图所示转化:
请回答:
(1)对上述反应或物质的下列说法正确的是 (填序号):
①物质A、B、C、D、F都是芳香化合物; ②物质D是一种环状醇,与乙醇是同系物;
②物质D是一种环状醇,与乙醇是同系物;
③物质F能使溴水和酸性高锰酸钾褪色;
④六种物质都能与金属钠反应放出氢气;
⑤上图转化涉及氧化、加成、消去、取代四种反应类型;
⑥A、B、F都在催化剂和加热条件下与氢气发生加成反应。
(2)物质A存在的官能团名称为 ,其化学式为 。
(3)F与溴水反应的生成物的结构简式为 ;
A与金属钠反应的化学方程式为 。
(4)物质C与D反应生成E化学方程式为 。
短周期元素A、B、C、D。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P轨道中有3个未成对电子。
(1)C原子的电子排布式为,若A为非金属元素,则按原子轨道的重迭方式,A与C形成的化合物中的共价键属于键(填“σ”或“π”)。
(2)当n=2时,B位于元素周期表的第周期族,BC2属于分子(填“极性”或“非极性”)。当n=3时,B与C形成的晶体属于晶体。
如图所示3套实验装置,分别回答下列问题。
(1)装置1中的Cu是极(填“正”或“负”),该装置发生的总反应的离子方程式为。
(2)装置2中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,左边石墨电极附近无明显现象。
① 电源的M端为极
② 乙烧杯中电解反应的离子方程式。
(3)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理装置3所示。
①请写出A、B两处物质的名称:A___________________B____________________
②请写出电解食盐水的离子方程式__________________________________________
锰是冶炼工业中常用的添加剂。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下: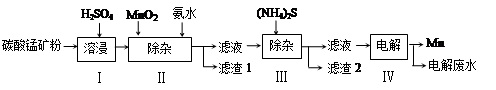
已知25℃,部分物质的溶度积常数如下:
| 物质 |
Mn(OH)2 |
Co(OH)2 |
Ni(OH)2 |
MnS |
CoS |
NiS |
| Ksp |
2.1×10-13 |
3.0×10-16 |
5.0×10-16 |
1.0×10-11 |
5.0×10-22 |
1.0×10-22 |
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是。
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是,加氨水调节溶液的pH为5.0-6.0,以除去Fe3+。
(3)步骤Ⅲ中,滤渣2的主要成分是 。
(4)步骤Ⅳ中,在(填“阴”或“阳”)极析出Mn,电极反应方程式为 。
(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。进行二级沉降的目的是 。
工业上可用煤制天然气,生产过程中有多种途径生成CH4。
(1)写出CO2与H2反应生成CH4和H2O的热化学方程式。
已知:① CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
② C(s)+2H2(g) CH4(g)ΔH=-73kJ·mol-1
CH4(g)ΔH=-73kJ·mol-1
③ 2CO(g) C(s)+CO2(g)ΔH=-171kJ·mol-1
C(s)+CO2(g)ΔH=-171kJ·mol-1
(2)另一生成CH4的途径是CO(g)+3H2(g) CH4(g)+H2O(g)。其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图所示。
CH4(g)+H2O(g)。其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图所示。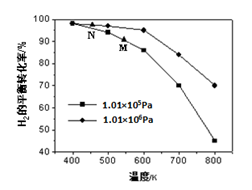
①该反应的△H0(填“<”、“=”或“>”)。
②实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由________________________。
③某温度下,将0.1 mol CO和0.3 mol H2充入10L的密闭容器内发生反应CO(g)+3H2(g)  CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K。(写出计算过程,计算结果保留两位有效数字)
CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K。(写出计算过程,计算结果保留两位有效数字)
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是________________
(2)实验室中现有Na2SO4、CuCl2、MgSO4、K2SO4等4种溶液,可与上述实验中CuSO4
溶液起相似作用的是________;
(3)要加快上述实验中气体产生的速率,还可采取的措施有________________(答两种)
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,
收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4mol/L H2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液 /mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O /mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①请完成此实验设计,其中:V1=,V6=,V9=;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因