(1)在原子序数为 1 — 18 号的元素中, 用适当的化学符号填写下列空白(稀有气体除外):
原子半径最大的是 ______ ;氧化性最强的单质是 _____ ;
酸性最强的含氧酸是 ________;属于两性氢氧化物的物质是______;
最稳定的气态氢化物 ;表示含有8个质子,10个中子的原子的化学符号 。
(2)苯环结构中不存在C-C单键与C=C双键的交替结构,可以作为证据的是
①苯不能使溴水褪色
②苯不能使酸性高锰酸钾溶液褪色
③苯在一定条件下既能发生取代反应,又能发生加成反应
④经测定,邻二甲苯只有一种结构
⑤经测定,苯环上碳碳键的键长相等,都是1.40×10-10m
(9分)下表为元素周期表的一部分,请回答有关问题:
| IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 4 |
⑨ |
⑩ |
(1)表中最活泼的金属是______,非金属性最强的元素是______;(填写元素符号)
(2) 最高价氧化物对应水化物酸性最强的化合物是__________;(填写分子化学式)
(3)表中能形成两性氢氧化物的元素是_______,分别写出该元素的氢氧化物与⑥、⑨的最高价氧化物对应水化物反应的离子反应方程式:
_____________________,___________________________;
(4)比较⑦、⑩单质氧化性的强弱:__________________________。
有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大,已知A和B 原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)元素名称: A ______ B _____ C _____ D ______。
(2)D元素位于周期表中周期族。
(3)写出AB2与C2B2反应的化学方程式。
(4)画出B的原子结构简图 ___________________。
(5)电子式表示化合物 C2D:。
用“大于”或“小于”或“等于”回答下列问题:
(1)酸性:H2CO3H2SiO3, H2SiO3H3PO4
(2)碱性:Ca(OH)2Mg(OH)2, Mg(OH)2Al(OH)3
(3)气态氢化物稳定性:H2OH2S, H2SHCl
(4)还原性: H2OH2S, H2SHCl
(5)酸性: H2SO4H2SO3, HClO4HClO
从以上答案中可以归纳出:
①元素的非金属性越强,其对应最高价氧化物水化物的酸性越;
②元素的金属性越强,其对应最高价氧化物水化物的碱性越。
、4g甲烷在氧气中燃烧生成二氧化碳和液态水,放出222.5KJ热量,写出甲烷燃烧的热化学方程式
有下列各组微粒或物质:
A、O2和O3B、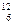 C和
C和 C C、CH3CH2CH2CH3和
C C、CH3CH2CH2CH3和
(1)组两种微粒互为同位素;
(2)组两种物质互为同素异形体;
(3)组两物质互为同分异构体;
(4)组两物质是同一物质。