Cu的化合物在生活及科研中有重要作用,不同反应可制得不同状态的Cu2O
(1)科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
①在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。当收集的N2体积为3.36L(已换算为标准状况)时,可制备纳米级Cu2O的质量为 ;
②一定 温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应:
温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应: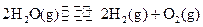
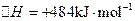 ;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为 ,t2时改变的条件可能为 ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平
;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为 ,t2时改变的条件可能为 ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平 衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为 ;
衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为 ;
(2)已知: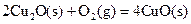 ΔH=-293kJ·mol-1
ΔH=-293kJ·mol-1 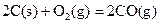 ΔH=-221kJ·mol-1
ΔH=-221kJ·mol-1
请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式 ;
(3)用电解法也可制备Cu2O。原理如右上图所示,则阳极电极反应可以表示为 。
从某些植物树叶提取的挥发油中含有下列主要成分:
(1)写出A的分子式
(2)1molB与溴水充分反应,需消耗mol单质溴。
(3)C与氢气完全加成后的产物的结构简式。
(4)已知:RCH=CHR,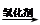 RCOOH+R,COOH。写出C在强氧化剂条件下生成的有机化合物的结构简式。
RCOOH+R,COOH。写出C在强氧化剂条件下生成的有机化合物的结构简式。
乙基香草醛( )是食品添加剂的增香原料。
)是食品添加剂的增香原料。
(1)写出乙基香草醛分子中任意两种含氧官能团的名称______________________。
(2)与乙基香草醛互为同分异构体,能与NaHCO3溶液反应放出气体,且苯环上只有一个侧链(不含R—O—R′及R—O—COOH结构)的有________种。
(3)A是上述同分异构体中的一种,可发生以下变化:
已知:ⅰ.RCH2OH  RCHO;
RCHO;
ⅱ.与苯环直接相连的碳原子上有氢时,此碳原子才可被酸性KMnO4溶液氧化为羧基。
a.写出A的结构简式:___________________________,
反应②发生的条件是______________________________。
b.由A可直接生成D,反应①和②的目的是_________________________。
c.写出反应方程式:A→B______________________________。
C与NaOH水溶液共热:___________________________________。
(4)乙基香草醛的另一种同分异构体E
(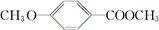 )是一种医药中间体。由茴香醛(
)是一种医药中间体。由茴香醛(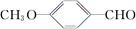 )合成E(其他原料自选),涉及的反应类型有(按反应顺序填写)________________________。
)合成E(其他原料自选),涉及的反应类型有(按反应顺序填写)________________________。
氯吡格雷(clopidogrel,1)是一种用于抑制血小板聚集的药物,根据原料的不同,该药物的合成路线通常有两条,其中以2氯苯甲醛为原料的合成路线如下: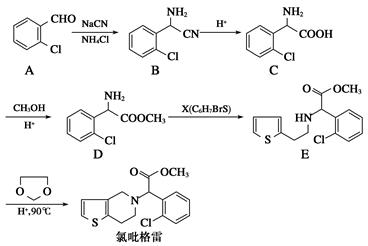
(1)分子D中的官能团名称为________________。X的结构简式为____________。
(2)分子C可在一定条件下反应生成一种产物,该产物分子中含有3个六元环,写出该反应的化学方程式______________________________________
(3)D→E的反应类型是________反应。
(4)写出A属于芳香族化合物的所有同分异构体的结构简式:__________。
(5)已知:CO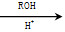 COROH
COROH COROR
COROR
则由乙醇、甲醇为有机原料制备化合物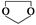 ,需要经历的反应类型有__________(填写编号)。①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物
,需要经历的反应类型有__________(填写编号)。①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物 的最后一步反应_______________________________________________。
的最后一步反应_______________________________________________。
脱水偶联反应是一种新型的直接烷基化反应,例如:
(1)化合物Ⅰ的分子式为________,1 mol该物质完全燃烧最少需要消耗________ mol O2。
(2)化合物Ⅱ可使________溶液(限写一种)褪色;化合物Ⅲ(分子式为C10H11Cl)可与NaOH水溶液共热生成化合物Ⅱ,相应的化学方程式为__________。
(3)化合物Ⅲ与NaOH乙醇溶液共热生成化合物Ⅳ,Ⅳ的核磁共振氢谱除苯环峰外还有四组峰,峰面积之比为1∶1∶1∶2,Ⅳ的结构简式为__________。
(4)由CH3COOCH2CH3可合成化合物Ⅰ,化合物Ⅴ是CH3COOCH2CH3的一种无支链同分异构体,碳链两端呈对称结构,且在Cu催化下与过量O2反应生成能发生银镜反应的化合物Ⅵ,Ⅴ的结构简式为__________,Ⅵ的结构简式为______________。
(5)一定条件下, 与
与 也可以发生类似反应①的反应,有机产物的结构简式为__________。
也可以发生类似反应①的反应,有机产物的结构简式为__________。
可降解聚合物P的合成路线如下:
已知:
(1)A的含氧官能团名称是________。
(2)羧酸a的电离方程式是________。
(3)B→C的化学方程式是________。
(4)化合物D苯环上的一氯代物有2种,D的结构简式是________。
(5)E→F中反应①和②的反应类型分别是________。
(6)F的结构简式是________。
(7)聚合物P的结构简式是________。