高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)请完成FeO42-与水反应的方程式:4FeO42-+10H2O 4Fe(OH)3+8OH-+_____。
4Fe(OH)3+8OH-+_____。
K2FeO4在处理水的过程中所起的作用是 和 。
(2)常温下,Fe(OH)3 的Ksp = 4.0×10-38,请写出Fe(OH)3在水中的溶解平衡方程式
(3)将适量K2FeO4配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。第(1)题中的反应为FeO42-变化的主反应,则温度对该反应的反应速率和平衡移动的影响是 ;发生反应的△H 0(填“>”、“<”或“=”)。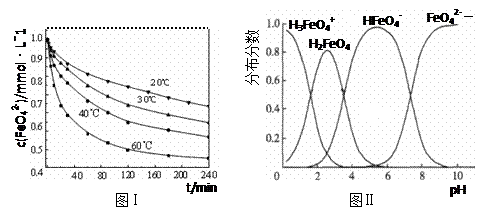
(4)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO4-的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:
H2FeO4+OH-=HFeO4-+H2O
(12分)反应aA(g)+bB(g) cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
回答问题:
(1)反应的化学方程式中,a:b:c为;
(2)A的平均反应速率vI(A)、vII(A)、vIII(A)从大到小排列次序为;
(3) B的平衡转化率aI(B)、aII(B)、aIII(B)中最小的是,其值是;
(4)由第一次平衡到第二次平衡,平衡移动的方向是,采取的措施是;
(5)比较第II阶段反应温度(T1)和第III阶段反应速度(T3)的高低:T2T3
填“>、=、<”判断的理由是;
(6)达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示IV阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C).
(10分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图: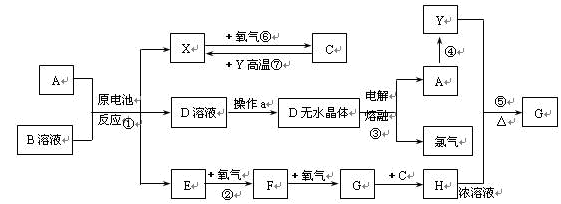
(注意:其中有些反应的条件及部分生成物被略去)
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为。
(2)从D溶液制备D的无水晶体的“操作a”为。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程为 。
(5)原电池反应①中正极的电极反应为。
(10分)⑴肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
⑵肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时:正极的电极反应式是 。
负极的电极反应式是 。
⑶右图是一个电化学过程示意图。
①锌片上发生的电极反应是 。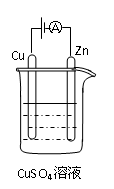
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变
化128g,则肼一空气燃料电池理论上消耗标准状况下的空气L
(假设空气中氧气体积含量为20%)
⑷传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反
应的离子方程式 。
(7分)用电石和水反应,产生的乙炔中含有H2S等杂质。某学生拟选用①NaOH溶液、②KMnO4溶液、③CuSO4溶液、④浓HNO3、⑤浓H2SO4中的一种除去H2S杂质,经研究最后他确定选用的溶液是 (填序号),如果没有该试剂,请你用其它试剂代替(写一种化学式) 。选用前者而发生的离子方程式为。但这一方程式所表示的制取原理与一般的情况有所不同,如强制弱、稳定制不稳定、难挥发制易挥发等,请用离子方程式表述将稀盐酸逐滴滴加到NaOH和Na2CO3混合溶液中的变化过程:。
(6分)利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖。在有机
物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物
分子中氢原子的种类和数目。例如乙醚的结构简式为:CH3—CH2—O—CH2—CH3
其核磁共振谱中给出的峰值 (信号)有两个,如下图所示:
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是
| A.CH3CH3 | B.CH3COOH | C.CH3COOCH3 | D.CH3OCH3 |
(2)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为: _____,请预测B的核磁共振氢谱上有个峰(信号)
_____,请预测B的核磁共振氢谱上有个峰(信号)